
شخصی سازی درمان در روانپزشکی همچنان چالش بزرگی است و پزشکان اغلب مجبورند با روش آزمون و خطا داروی مناسب را برای هر بیمار پیدا کنند. الکتروانسفالوگرافی کمّی (QEEG) و شاخصهایvigilance پنجرهای عینی به تنظیم بیداری مغز ارائه میدهند که عاملی مؤثر در اختلالات روانی مختلف است. vigilance به سطح هوشیاری یا برانگیختگی مغز اشاره دارد که یک فرد میتواند آن را حفظ کند، و شامل توانایی بیدار ماندن، هشیار بودن و پاسخگویی به محرکها در طول زمان است.
این مفهوم از هوشیاری بالا (فعالیت سریع غالب EEG) تا خوابآلودگی و الگوهای شروع خواب متغیر است و ارتباط نزدیکی با سطح کلی arousal دارد، اما کاملاً با آن یکسان نیست. arousal به سطح فعالسازی آنی سیستم عصبی مرکزی اشاره دارد (مثلاً در پاسخ به محرکهای ناگهانی) ، در حالیکهvigilance بر ظرفیت و تنظیم حفظ وضعیت هشیاری بالاتر از یک آستانه مشخص، در طول زمان دلالت دارد. در گذشته، vigilance به معنی اصطلاحاتی مانند sustained attention (توجه پایدار) یا wakefulness (بیداری) بهکار میرفت که منجر به نوعی سردرگمی میشد، اما در عمل، بهتر است بهعنوان توانایی مغز برای رسیدن و حفظ یک سطح کافی از alertness (یا arousal) برای مدت مشخصی معنی شود.
تحقیقات اخیر نشان میدهند که شاخصهای خاصvigilance مانند پایداری آن در طول زمان، متوسط مقدار آن، افت زود هنگام به مراحل پایین یا برعکس، حالت بسیار پایدار و غیره، با فنوتیپهای بالینی و میزان پاسخدهی به دارو، در شرایطی مانند اختلال افسردگی اساسی (MDD)، اختلال کم توجهی/بیش فعالی (ADHD)، اختلال اضطراب فراگیر (GAD) و اختلال دو قطبی مرتبط هستند.
پلتفرمهایی مانندQEEGhome ، ارزیابی vigilance مبتنی بر EEG را به عنوان بخشی از گزارشهای نقشه مغزی خود ارائه میکنند و دادههایی کمّی در مورد تنظیم برانگیختگی مغز بیمار را در قالب کاربرد بالینی فراهم میکنند.
این مقاله به ارزیابی Vigilance در روانپزشکی بالینی، اهمیت و کاربردها و بررسی چگونگی استفاده از پروفایلهای vigilance استخراج شده از QEEG برای انتخاب دارو میپردازد. همچنین مفاهیم با مثالهای موردی شرح داده میشود. هدف، این است که به بالینگران کمک شود تا شاخصهای vigilance را در برنامهریزی درمانی خود وارد کنند و نتایج بهتری کسب کنند.
تمایز قائل شدن بین vigilance و مفاهیم مرتبطی مانند arousal level و attention اهمیت زیادی دارد. vigilance را میتوان به عنوان توانایی رسیدن و حفظ یک وضعیت alertness بالاتر از یک آستانه پایه، برای مدتی مشخص تعریف کرد. در حالی که، arousal معمولاً به سطح فعال سازی آنی یا افزایش phasic alertness اشاره دارد (برای مثال، افزایش هشیاری بعد از شنیدن یک صدای بلند). بنابراین، arousal یک مؤلفه از vigilance محسوب میشود، در حالی که vigilance بُعد زمانی نیز دارد، یعنی بازتابدهندهی این است که فرد تا چه مدت و با چه کیفیتی میتواند هشیار باقی بماند.
اصطلاح alertness اغلب برای توصیف وضعیت فعلی بیداری یا هشیاری در یک مقیاس کمّی به کار میرود (از خواب آلودگی تا هشیاری کامل)، در حالی که attention یک جهتگیری شناختی یا تمرکز را به alertness اضافه میکند (یعنی ممکن است فرد هشیار باشد اما روی کار خاصی متمرکز نباشد). از نظر روانپزشکی، vigilance و arousal بخشی از معاینه وضعیت روانی (mental status examination) هستند. به این نحو که hypoarousal (کاهش بیش از حد سطح هشیاری) ممکن است بهشکل آرام بخشی یا کاهش شفافیت هوشیاری ظاهر شود، در حالی که hyperarousal (افزایش بیش از حد هشیاری) میتواند بهشکل اضطراب، بیخوابی یا تحریک پذیری بروز کند.
vigilance بهطور خاص به تنظیم این حالات arousal اشاره دارد اینکه هشیاری فرد چقدر پایدار یا متغیر است و با چه سرعتی میتواند به محرکهای محیطی واکنش نشان داده و آنها را حفظ کند. در مجموع، vigilance و arousal هر دو به وضعیت هشیاری مغز اشاره دارند، اما vigilance بر ظرفیت پایدار و جنبه تنظیمی آن تأکید میکند. یعنی اینکه سیستم arousal چگونه در طول زمان چگونه مدیریت میشود. این عامل در بسیاری از اختلالات روانپزشکی از اهمیت بالایی برخوردار است.
پزشکان و پژوهشگران چندین روش برای ارزیابی vigilance یا سطح brain arousal در اختیار دارند؛ که هر کدام مزایا و محدودیتهای خاص خود را دارند:
سادهترین روش، مشاهده سطح alertness بیمار در حین مصاحبه یا استفاده از مقیاسهای سنجش است. برای مثال، ممکن است پزشک متوجه شود که بیمار به راحتی به خواب میرود یا بیش از حد هشیار (hyperalert) است. پرسشنامههای subjective مانند Epworth Sleepiness Scale یا مقیاسهایی که توسط بالینگر تکمیل میشوند، میتوانند میزان خوابآلودگی یا هشیاری در طول روز را ثبت کنند.
این روشها، ساده و در دسترس هستند اما subjective بوده و دارای دقت پایینی میباشند. آزمونهای روانحرکتی (psychomotor tests) یا آزمونهایی مثل Psychomotor Vigilance Test (PVT) عملکرد sustained attention را در طول زمان میسنجند و از این طریق بهطور غیرمستقیم سطح vigilanceرا نشان میدهند. این آزمونها، نیاز به همکاری فعال بیمار دارند و صرفاً از رفتار فرد، و نه از ثبت مستقیم مولفههای الکتروفیزیولوژیکی برای نتیجهگیری در مورد فعالیت مغز استفاده میکنند.
روشهای پیشرفته از جمله PET (تصویربرداری با توموگرافی نشر پوزیترون) و fMRI (تصویربرداری تشدید مغناطیسی عملکردی) برای بررسی الگوهای فعالیت مغز در حالتهای مختلف بهکار میروند. مطالعات با PET/fMRI نشان دادهاند که کاهش vigilance بر پایه EEG با کاهش فعالیت قشر مغز مرتبط است. با این حال، این روشها هزینهبر و دارای وضوح زمانی پایین برای بررسی تغییرات لحظهای هستند. همچنین، برای استفاده روزمره در کلینیکها کاربردی نمیباشند و بیشتر جنبه تحقیقاتی دارند. به عبارتی دیگر، کاربرد اصلی آنها در تأیید و اعتبارسنجی یافتههای EEG و نه در پایش روزمره است.
EEG مستقیمترین و عملیترین روش برای ارزیابی vigilance است، زیرا تغییرات فعالیت الکتریکی مغز را در طول زمان ثبت میکند که با تغییرات در سطح vigilance مطابقت دارد. در طول بیداری، مغز از حالتهای عملکردی متمایزی به نام مراحل هوشیاری (مشابه مراحل خواب) عبور میکند که از هوشیاری کامل تا خواب آلودگی متغیر است. این مراحل در الگوهای EEG منعکس میشوند. برای مثال، هوشیاری بالا (alert wakefulness) با فعالیت سریع فرکانسهای پایین و سرکوب امواج آلفا مشخص میشود، در حالی که بیداری آرام با ریتم آلفای برجسته همراه است، و هوشیاری پایین (خوابآلودگی) با کند شدن EEG و حرکات آهسته چشم مشخص میگردد. با ثبت EEG در حالت استراحت به مدت ۱۵–۲۰ دقیقه در حالی که بیمار آرام اما بیدار است، میتوان نوسانات سطح vigilance مغز و نحوه حفظ آن را بدست آورد.
تحلیل کمّی EEG یا QEEG میتواند هر لحظه از ثبت، مراحل vigilance را طبقهبندی کند و معیارهایی مانند مدت زمانی که بیمار در حالات vigilance بالا بود، مدت زمانی که بیمار در vigilance پایین باقی میماند و سرعت انتقال به خوابآلودگی را کمّی سازی نماید. این رویکرد در برابر آزمونهای استاندارد آزمایشگاهی (مانند آزمون تأخیر خواب چندگانه) و تصویربرداری عصبی اعتبار سنجی شده است و دارای وضوح زمانی برتر و راحتی بیشتری است.
بخش "Vigilance" در گزارشهای نقشه مغزیQEEGhome ، یافتههای پیچیدهی EEG را به شکلی قابل فهم و کاربردی برای بالینگران نمایش میدهد. این بخش شامل نمودار مراحل vigilanceدر طول زمان ثبت و شاخصهایی از ثبات آن است. درک دقیق این پارامترها، برای تفسیر بالینی ضروری میباشد.
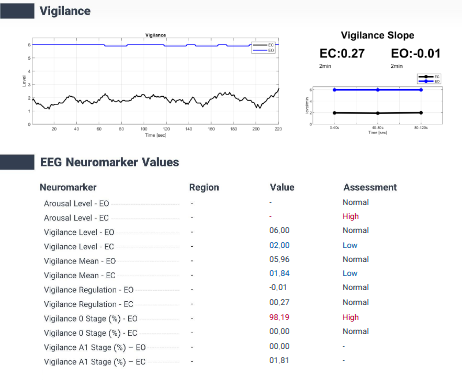
EEG بیمار در این بخش به مراحلی از بیداری کامل تا آستانهی خواب دسته بندی میشود، اگر بیمار بیشترِ زمان را در بالاترین مرحلهی vigilance (نشانهی بیداری هشیار با فعالیت سریع EEG) گذرانده باشد، نشان دهندهی وضعیت hypervigilant یا hyperaroused مغز است، که معادل اضطراب، تنش درونی، یا بیقراری میباشد. اگر بیمار زمان قابل توجهی را در مراحل پایینتر vigilance سپری کرده باشد، نشان میدهد که، مغز بهصورت مکرر بهسمت حالت خواب میرود، که الگوی arousal ناپایدار را نشان میدهد و با اختلالاتی مانند خستگی، ADHD، یا نارساییهای شناختی مرتبط است. در پروفایل نرمال، الگویی که در آن بیمار ابتدا در حالت alert باقی میماند ولی بهتدریج و بصورت طبیعی در پایان ثبت وارد حالت drowsy میشود، مشاهده میشود.این امر نشان از نرمال بودن Vigilance است.
آنالیز نقشه های مغزی گروه QEEGhome سرعت گذار بیمار به مراحل پایینتر vigilance را نیز نشان میدهد. اگر EEG خیلی زود و به دفعات به حالت drowsy برود، گزارش به عنوان“unstable vigilance profile” شناخته میشود. چنین حالتی از لحاظ بالینی، معادل با خواب آلودگی در طول روز یا کاهش تمرکز در محیط بدون تحریک است. برعکس، اگر EEG در طول ضبط در حالت alert باقی بماند و تغییر کمی نشان، الگو به عنوان “hyperstable” گزارش میشود. در چنین شرایطی، احتمالاً بیمار میگوید: «همیشه ذهنم فعاله» یا «نمیتونم آروم بگیرم».
در گزارشهای نقشه مغزی QEEGhome، شاخص عددی به نامvigilance regulation ارائه میشود. نمرههای بالاتر معادل ثبات بیشتر در arousal (اغلب به معنای باقی ماندن در حالت alert) است، در حالی که، نمرههای پایینتر معادل نوسانات بیشتر یا افتهای سریع به خواب آلودگی است. کاربرد بالینی این معیار میتواند به ما کمک کند که با مشاهده الگوی ناپایدار، به بررسی ADHD، خواب آلودگی، یا اثرات دارویی (مثلاً آرامبخشها) و با مشاهده الگوی باثبات بیش از حد، به بررسی اضطراب، پرکاری تیروئید، یا مصرف محرکها (stimulants) بپردازیم.
گزارشهای نقشه مغزی QEEGhome شامل مقایسه داده فرد با پایگاه دادهی نرمال، از نظر معیارهای vigilance است. این مقایسه کمک میکند تا بفهمیم آیا تنظیم vigilance بیمار به طور قابل توجهی غیر طبیعی است یا خیر. مثلاً باقی ماندن طولانی مدت در vigilance بالا نشانهای از اضطراب یا بی خوابی مزمن است یا افت زود هنگام آن، به علت خواب آلودگی، تأیید شکایات از خستگی ذهنی یا عدم تمرکز است.
برای تفسیر بالینی دقیق، باید یافتههای EEG را با علائم روان پزشکی بیمار ترکیب کرد. ممکن است در گزارش، تفسیرهایی ارائه شود: مانند الگوی نشان دهندهی ثبات پایینvigilance ، که با مشکلات توجه مرتبط است. برای نمونه، بیمار افسرده با پروفایل hyperstable میتواند توجیهی برای بررسی بیخوابی، تنش درونی، و ناتوانی در آرام سازی ذهن علیرغم خستگی باشد. یا بیمار ADHD با پروفایل vigilance ناپایدار و micro-sleep های مکرر میتواند توجیه کننده علت خواب آلودگی در محیطهای ساکت (مثل کلاس درس) باشد. این اطلاعات میتواند در هدایت درمان فردمحور کمک کند. برای مثال پروفایلhyperaroused پاسخ بهتر به آرام سازی، داروهای خوابآور و تکنیکهای مدیتیشن میدهد، در حالی که پروفایل under-aroused پاسخ بهتر به محرکها، فعالیت روزانه منظم، و داروهای psychostimulantمیدهد.
بسیاری از بیماران مبتلا به افسردگی اساسی، تنظیم vigilance بسیار پایدار (hyperstable) را نشان میدهند که بازتاب ناتوانی در “خاموش کردن” حالت بیداری بالا است. Hegerl و همکاران (2012) دریافتند که بیماران افسرده نسبت به افراد سالم، زمان بیشتری را در بالاترین مرحلهvigilance میگذرانند و زمان کمتری را در مراحل خواب آلودگی سپری میکنند. به عبارت دیگر، EEG آنها در حالت هوشیاری و غالب بر فعالیت آلفا باقی میماند و افت به مراحل پایینتر هوشیاری در طول استراحت، دیرتر و کمتر اتفاق میافتد. این یافته عینی با مشاهدات بالینی همخوانی دارد. بزرگسالان افسرده اغلب گزارش تنش درونی، نشخوار فکری (rumination) و تأخیر در به خواب رفتن (مشکل در شروع خواب) را میدهند که همگی نشانههای افزایش vigilance هستند. جالب این است که بیماران دو قطبی در دوره افسردگی نیز الگوهای EEG مشابه فوق پایدار نشان میدهند. این افزایش پایهای vigilance اهمیت پاتوژنتیکی دارد و با ناتوانی در تنظیم عاطفی مرتبط است.
نکته مهم این است که شاخصهای vigilance با پاسخ به درمان ضد افسردگی همبستگی دارد. در مطالعهای که توسط Schmidt و همکاران (2017) صورت گرفت، نتایج حاکی از آن است که بیماران مبتلا به MDD که دارو دریافت نکرده بودند و بعداً به درمان ضد افسردگی پاسخ دادند، در ابتدا vigilance بالایی داشتند و زمان بیشتری را در سطح بالای vigiance سپری کردهاند. به عبارت دیگر، پاسخدهندگان، قبل از درمان، سطح بیداری مغزی بیشتری داشتند. علاوه بر این، با پیشرفت درمان، پاسخ دهندگان به دارو، کاهش بیشتری در vigilance نشان دادند.
این یافتهها از این ایده حمایت میکند که اختلال در تنظیم vigilance پیش بینی کننده نتایج درمان در افسردگی است. به همین ترتیب، درمانهای سریع الاثر هم این الگو را نشان دادهاند. در آزمایشی با کتامین داخل وریدی برای افسردگی مقاوم به درمان ، پاسخدهندگان به دارو، پروفایل EEG متمایزی با سطح بالاتر vigilance پیش از تزریق داشتند که در غیر پاسخ دهندگان دیده نشد.
از نظر انتخاب دارو، پروفایلهای vigilance ممکن است به تفکیک زیر نوعهای افسردگی و هدایت درمان نیز کمک کند. دستورالعملهای بالینی (APA، 2010) توصیه میکنند که بیشتر بیماران مبتلا به MDD با داروهای SSRI یا ضد افسردگیهای مشابه شروع به درمان شوند. در واقع، SSRIها و SNRIها به دلیل ایمنی مناسب و اثر بخشی گسترده، گزینههای خط اول هستند و علائم اضطرابی که اغلب همراه افسردگی هستند را نیز درمان میکنند. برای اکثر بیماران افسردهای که الگوهای EEG با vigilance بالا و فوقپایدار دارند، این ضد افسردگیهای استاندارد میتوانند مؤثر باشند، همانطور که مطالعات بالا نشان دادند، vigilance بالا پیش بینی کننده پاسخ خوب به SSRIs و کتامین است.به عبارتی دیگر، ضد افسردگیها از طریق اثر روی ناحیه لوکوس سرولئوس و سیستمهای بیداری، در کاهش vigilance اثر داشته و در نهایت اجازه میدهند مغز تنظیم vigilance سالمتری داشته باشد. مطابق با این، Hegerl و همکاران اشاره کردند که پاسخ دهندگان به SSRIs کاهش سریعتری در بیداری سیستم عصبی مرکزی در اوایل درمان نسبت به غیر پاسخ دهندگان داشتند.
از طرف دیگر، برخی بیماران افسرده الگوی vigilance متضادی نیز دارند. یعنی بیداری پایین یا vigilance کم که با رخوت، خواب آلودگی بیش از حد در طول روز یا ویژگیهای “غیر معمول” مانند خواب زیاد مشخص میشود. از منظر EEG، این افراد ممکن است در طول استراحت به سرعت به مراحل پایین vigilance بروند. چنین بیمارانی معمولاً بیشتر با مشکل انگیزه و انرژی مواجهاند تا تنش. مدل بیداری پیش بینی میکند که این گروه ممکن است به درمانهای فعال کننده بهتر پاسخ دهند. Hegerl و همکاران پیشنهاد کردند که این زیرگروه افسردگی (که گاهی با افسردگی غیر معمول همپوشانی دارد) میتواند از افزایش دهندههای هوشیاری مانند روان تحریک کنندهها بهرهمند شود. آنها اشاره میکنند که “بیمارانی که خواب زیاد یا خستگی دارند، اغلب نشانههایی از کاهش تنظیم vigilance را نشان میدهند و ممکن است به روان تحریک کنندهها پاسخ دهند.” اگر چه روان تحریک کنندهها ضدافسردگیهای خط اول نیستند، ولی مطالعات کوچک و استفاده خارج از برچسب (مثل متیل فنیدات یا مودافینیل در افسردگی) در موارد سخت نشان دادهاند که ممکن است مؤثر باشند.
بنابراین، اگر ارزیابی vigilance پروفایل ناپایدار و با هوشیاری پایین در بیمار افسردهای که به SSRIs پاسخ نداده است نشان دهد، پزشک ممکن است درمانی فعالتر را در نظر بگیرد. این درمان میتواند شامل تغییر دارو یا افزودن دارویی باشد که سطح نوراپینفرین/دوپامین را افزایش میدهد (مانند بوپروپیون یا مودافینیل)، تا درمان با فیزیولوژی مغزی بیمار همسو شود. دستورالعملها نیز اشاره دارند که بیماران با خستگی یا بیحالی شدید ممکن است به ضد افسردگیهای فعال کننده یا افزایش دهنده نیاز داشته باشند (هرچند روان تحریک کننده ها باید با احتیاط استفاده شوند). برعکس، بیمار با پروفایل فوق پایدار (تنش بالا، بیخوابی) ممکن است بیشتر از ضد افسردگیهای آرام بخش (مثل میرتازاپین با دوز پایین یا TCA شبانه) یا ترکیبی که هم بیداری بیش از حد و هم مشکلات خواب را هدف قرار میدهد بهره ببرد.
به طور خلاصه، برای افسردگی اساسی، شاخصهایvigilance به طبقهبندی بیماران کمک میکنند. کسانی که vigilance بالا و پایدار دارند (که در افسردگی ملانکولیک بزرگسالان رایج است) معمولاً به SSRIs/SNRIs استاندارد پاسخ میدهند، در حالی که کسانی که vigilance پایین یا ناپایدار دارند ممکن است به درمانهای جایگزین یا مکمل برای افزایش بیداری مغزی نیاز داشته باشند. شناسایی زود هنگام این الگوها میتواند فرآیند آزمون و خطا را کوتاه کند و انتخاب دارو را از ابتدا بهتر هدایت نماید.
افسردگی در نوجوانان نیز، شامل اختلال در تنظیم بیداری است. اگرچه دادهها در این زمینه محدودتر هستند ولی یک مطالعه مقدماتی نشان داد که نوجوانان افسرده سطح vigilance بالاتری نسبت به گروه کنترل دارند، که مشابه یافتههای بزرگسالان است. با این حال، جوانان مبتلا به افسردگی، گاهی ویژگیهای غیر معمول بیشتری (مثل خواب زیاد) نشان میدهند. به هر حال، دستورالعملهای درمانی افسردگی کودکان و نوجوانان نیزSSRIs (مثلاً فلوکستین) را به همراه روان درمانی به عنوان خط اول توصیه میکند و پروفایلهای vigilance ممکن است در آینده ابزاری برای شخصی سازی این انتخابها باشند.
مثلاً کودک یا نوجوانی که سطح بالایی از vigilance دارد، ممکن است نیاز به ملاتونین یا ضد افسردگی آرام بخش در شب برای خواب داشته باشد. برعکس، کسی که سریع خواب آلود میشود ممکن است از روشهای فعال کننده روزانه (نور درمانی، ورزش، یا در موارد مقاوم تحت نظارت دقیق استفاده از روان تحریک کننده ها یا مودافینیل) بهرهمند شود تا اثر ضد افسردگی بهبود یابد.
ADHD به طور کلاسیک با کاهش بیداری قشری و ناپایداری vigilance همراه است، به ویژه در وظایفی که نیاز به توجه مداوم دارد. بسیاری از کودکان و بزرگسالان مبتلا به ADHD در حفظvigilance و تمرکز بدون تحریکات خارجی مشکل دارند. EEGاین افراد معمولاً شامل افزایش فعالیت تتا و امواج کند نسبت به فعالیت بتا است. این امر نشان دهنده مغزی است که به راحتی به خواب آلودگی یا حالت غیر فعال میافتد. از نظر مراحل vigilance، بیماران ADHD اغلب هنگام آرام نشستن به سرعت به مراحل پایینتر vigilance میرسند. Berger و همکاران (2021) گزارش کردند که کودکان مبتلا بهADHD نسبت به همسالان افسرده خود، میانگین سطح vigilance پایینتری داشتند که نشان دهنده گرایش به کاهش بیداری در گروه ADHD است. این یافته با مدل تنظیم بیداری در ADHD هماهنگ است. کاهش مزمن بیداری باعث میشود کودک به طور ناخودآگاه به دنبال تحریک باشد (مثلاً تکان خوردن یا بیش فعالی) تا به عنوان مکانیزم خود تنظیمی، بیدار و هوشیار بماند. Hegerl و همکاران، بیش فعالی و جستجوی تحریک در ADHD را تلاشی برای «ایجاد محیط تحریک کننده به منظور تثبیت vigilance» توصیف کردهاند. به عبارت دیگر، مغز ADHD شبیه ماشینی است که اغلب کند یا خاموش میشود (vigilance پایین) و کودک با فشار دادن “پدال گاز” (حرکت، نوآوری) سعی در روشن نگه داشتن آن دارد.
ADHD و حالت مانیا هر دو تنظیم vigilance ناپایداری دارند. عملاً EEG این افراد میتواند در عرض چند دقیقه استراحت آرام به مرحله B یا حتی مرحله C (نشانههای خواب آلودگی) سقوط کند. مشاهده شده است که بلافاصله پس از بسته شدن چشمها، بیمارانADHD سریعتر از افراد بدون ADHD الگوهای خواب آلودگی را نشان میدهند. قابل توجه است که این اتفاق اغلب به دلیل خواب یا آرامش کافی نیست، بلکه یک ویژگی ذاتی کم فعال بودن است. این ناپایداری vigilance با اختلالات توجه درADHD مرتبط است که در شرایط یکنواخت و کم تحریک (مثلاً کلاسهای طولانی، تکالیف خواندنی) شدیدتر میشود.
مؤثرترین داروها برای ADHD روان تحریک کنندهها هستند که بیداری سیستم عصبی مرکزی را افزایش میدهند. طبق دستورالعمل آکادمی اطفال آمریکا (AAP) و سایر منابع ، داروهای محرک (متیلفنیدات، مشتقات آمفتامین) به عنوان درمان دارویی خط اول برای ADHD در کودکان مدرسهای، نوجوانان و بزرگسالان توصیه شدهاند. در واقع، محرکها از پرمطالعهترین روان داروها هستند و شواهد قوی نشان میدهد که این داروها، توجه را نرمال کرده و رفتارهای بیش فعال را در حدود 70-80٪ بیماران، با افزایش بیداری قشری و بهبود تنظیم vigilance کاهش میدهند (Childress & Sallee, 2014). از دیدگاه QEEG، درمان با محرکها، معمولاً، تتای اضافی را کاهش داده، بتا را افزایش داده و EEG را در مرحله vigilance بالاتری تثبیت میکند. مطالعات بالینی نشان دادهاند که مداخلاتی که vigilance را تثبیت میکنند، میتوانند علائم ADHD را تسکین دهند. به عنوان مثال، تجویز محرکها یا اصلاح کمبود خواب به بهبود توجه کمک میکند. یک تحقیق جالب حتی پیشنهاد میکند که محرکها ممکن است در شرایطی فراتر از ADHD که vigilance ناپایدار است، مفید باشند (همانطور که بعداً درباره مانیا در اختلال دوقطبی بحث خواهد شد).
بنابراین، پروفایل vigilance بیمار ADHD معمولاً تصمیم به استفاده از محرکها را تأیید میکند. اگر میانگین مرحله هوشیاری پایین باشد و خواب آلودگی زودرس آشکار باشد، میتوان با اطمینان گفت که محرک برای افزایش بیداری لازم است. دستور العملهای رسمی اشاره میکنند که حدود 90٪ بیماران به یکی از اشکال محرکها یا آتوموکستین پاسخ میدهند، که با درمان کمبود اصلی بیداری سازگار است. آتوموکستین (SNRI غیرمحرک) نیز به عنوان داروی خط اول یا دوم در نظر گرفته میشود؛ اثر بخشی آن (گرچه کمی کمتر از محرکها) ممکن است به افزایش نوراپینفرین قشری و در نتیجه افزایش متوسط vigilance مربوط باشد.
با این حال، مواردی وجود دارد که شاخصهای Vigilance ممکن است نیاز به تنظیم درمان را نشان دهند. ADHD در بزرگسالان اغلب با اضطراب یا اختلالات خلقی همراه است. اگر QEEG فرد بزرگسالی که شکایت از عدم توجه دارد، Vigilance بسیار پایدار و بالایی نشان دهد، باید در نظر گرفت که علائم “ADHD” ممکن است ناشی از اضطراب یا فرآیند دیگری باشد، نه کاهش بیداری کلاسیک ADHD. در چنین شرایطی، استفاده از محرک ممکن است بیداری را بیش از حد بالا ببرد و اضطراب، بیخوابی یا تحریک پذیری را تشدید کند. از نظر بالینی، ممکن است ابتدا با داروی غیر محرک یا درمان اضطراب (مثلاً استفاده از SSRI یا آگونیست آلفا-2 مانند گوانفاسین که اثرات آرامبخش ملایمی دارد) شروع شود. برعکس، اگر کودکی با ADHD دچار Vigilance بسیار ناپایداری باشد و در حفظ هوشیاری مشکل داشته باشد، این امر، نیاز به مصرف داروهای محرک و شاید استراتژیهای رفتاری برای ایجاد وقفههای تحریک کننده مکرر را نشان میدهد.
ADHD نمونه بارز اختلال با vigilance پایین است و درمان به طور صریح برای افزایش و تثبیت سطح vigilance طراحی شده است. اندازه گیریهای vigilance میتواند تشخیص را تأیید کرده و در موارد پیچیده، انتخاب بین محرک و غیر محرک را بر اساس وجود یا عدم وجود vigilance بالا آسانتر کند.
اختلالات اضطرابی با نگرانی بیش از حد و غیر قابل کنترل مشخص میشود، که اغلب با علائم فیزیولوژیکی تنش، بیقراری و بیخوابی همراه است. انتظار میرود که این اختلال به صورت یک حالت vigilance بالا ظاهر شود. در واقع، از نظر شناختی، بیماران مبتلا به اختلالهای اضطرابی نسبت به تهدیدها بسیار هوشیار بوده و در آرام شدن مشکل دارند.
در حالت استراحت با چشمهای بسته، بسیاری از بیماران اضطرابی انحراف قابل توجهی از EEG طبیعی نشان نمیدهند. همچنین، توزیع کلی مراحل vigilance در حالت استراحت، نسبتاً نرمال به نظر میرسد. معمولاً وقتی بیمار مضطرب در معرض استرس یا تحریک قرار میگیرد (یا سعی میکند شب بخوابد) hyper arousal بودن او آشکار میشود. با این حال، چند نکته مهم در رابطه با ارتباط نشانگرهای EEG با پاسخ درمانی اضطراب وجود دارد.
یک یافته مکرر در QEEG بیماران اضطرابی، افزایش قدرت بتا، به ویژه در نواحی قشری مرتبط با اضطراب (مثلاً لوبهای تمپورال) است. امواج بتا با هوشیاری، تفکر فعال و گاهی تنش همراه هستند. مطالعهای در سال ۲۰۲۳ توسط Byeon و همکاران انجام شد، که نشان داد که در میان بیماران اختلالات اضطرابی که با داروهای SSRI/SNRI درمان شدند، کسانی که به دارو پاسخ دادند، فعالیت بتای پایه بالاتر (خصوصاً بتای بالا در نواحی تمپورال) و نسبت تتا/بتا (TBR) پایینتری نسبت به مقاومان به درمان داشتند. این امر مشابه یافتههای افسردگی است. بیمارانی که نشانگرهای بیداری بالاتری دارند، احتمال بیشتری دارد که از درمان دارویی استاندارد بهرهمند شوند. اگرچه این مطالعه به طور مشخص از نمره دهی مراحل vigilance استفاده نکرد، قدرت بتا میتواند به عنوان معیاری برای EEG با vigilance بالا در نظر گرفته شود و TBR پایین نشان دهنده فعالیت کمتر تتا و خواب آلودگی است.
از نظر دستورالعملها، درمانهای خط اول برای اختلالهای اضطرابی شامل داروهای ضد افسردگی (SSRI یا SNRI) و یا روان درمانی هستند. SSRIها (مانند سرترالین، اسیتالوپرام) یا SNRIها (ونلافاکسین، دولوکستین) در کاهش اضطراب مزمن در اکثر بیماران مؤثر بوده و به عنوان درمان دارویی اولیه توصیه میشوند. این داروها مانند بنزودیازپینها، ایجاد خواب آلودگی نمیکنند، اما طی چند هفته، با تنظیم مسیرهای سروتونین و نوراپینفرین، vigilance بالا و نگرانی را کاهش میدهند.
اگر بیمار اضطرابی پروفایل vigilance بالایی داشته باشد، به احتمال زیاد دچار بیخوابی مزمن و تنش است. برای چنین بیماری، به منظور کاهش نگرانیهای ذهنی، میتوان از SSRI/SNRI بهره برد و ممکن است به اقدامات کمکی برای کاهش vigilance، مانند مدیتیشن یا استفاده کوتاه مدت از داروی خوابآور در شب نیاز باشد.
از سوی دیگر، برخی بیماران مضطرب به طور پارادوکسیکال از خستگی و مشکلات تمرکز شکایت دارند. اگرQEEG در این افراد افت زود هنگام vigilance را نشان دهد، ممکن است درمان با انتخاب داروی ضد افسردگی کمی تحریک کنندهتر یا افزودن عنصر تحریک کننده تنظیم شود. برای مثال، بوسپیرون که یک ضد اضطراب غیر خواب آور است، میتواند در صورت نگرانی از تحریک بیش از حد بیمار خسته بدون استفاده از بنزودیازپین، اضافه شود. بوسپیرون میتواند بتای فرونتال را افزایش داده و سطح vigilance را بهبود بخشد. همچنین، اگر بیمار انرژی پایینی داشته باشد، ممکن است دولوکستین به جای SSRI انتخاب شود.
توجه به این امر مهم است که برخلاف افسردگی یا ADHD، استفاده از محرکها در اختلالهای اضطرابی به طور خالص، معمولاً توصیه نمیشود (ممکن است اضطراب را بدتر کنند). اما اگر پروفایل بیمار نشان دهنده وجود همزمان کم فعالی (مثلاً همراه با بیتوجهی یا افسردگی) باشد، ممکن است تجویز دارو هایی مانند مودافینیل برای خستگی باقیمانده در بیمار مضطرب افسرده با نظارت دقیق میتواند مفید باشد. بنزودیازپینها و داروهای خواب آور، در حالی که به عنوان ضد اضطراب کوتاه مدت مؤثرند، بیداری قشری را کاهش میدهند (هرچند بتا را نیز به طور پارادوکسیکال افزایش میدهند اما به صورت عملکردی آرام بخش هستند). دستورالعملها توصیه میکنند که بنزودیازپینها به دلیل خطر وابستگی، فقط برای استفاده کوتاه مدت یا خط دوم محفوظ بمانند. اگر QEEG نشان دهنده hyperarousal شدید باشد، ممکن است دوره کوتاهی از بنزودیازپین یا افزودنی آرام بخش (مانند هیدروکسیزین یا پرگابالین، هر دو که میتوانند اضطراب جسمانی را کاهش داده و خواب آلودگی نسبی ایجاد کنند) برای شکستن چرخه hyper vigilance موجه باشد.
کودکان مضطرب معمولاً رفتارهای hyper vigilant دارند یعنی زود میترسند، نگرانند و بیخواب هستند. انتظار میرود بسیاری از نوجوانان مضطرب نیز vigilance بالایی داشته باشند. درمان در کودکان معمولاً با رواندرمانی آغاز میشود و برای موارد متوسط تا شدید از SSRI استفاده میشود. اگر EEG کودک مقدار زیادی بتا و پایداری بالایی نشان دهد (و ADHD رد شده باشد)، ممکن است استفاده از SSRI برای کاهش آن بیداری تایید شود. در کل، نشانگرهای vigilance در اختلالهای اضطرابی، عمدتاً حضور میزان بالای vigilance را تایید میکنند و میتوانند به طور ظریف بر انتخاب دارو یا افزودنی (آرام بخش یا محرک) تأثیر بگذارند.
اختلال دوقطبی یک مورد خاص است که تنظیم vigilance در آن بسته به وضعیت (State-dependent) تغییر میکند. بیمار دوقطبی ممکن است در دورههای افسردگی با vigilance پایدار و ثابت (شبیه به افسردگی تکقطبی) و در دورههای شیدایی با vigilance ناپایدار و نوسانی داشته باشد. این موضوع در مطالعهای توسط Wittekind و همکاران (۲۰۱۶) که vigilance در افسردگی دوقطبی و شیدایی دوقطبی را مقایسه کردهاند، نشان داده شده است.
بیماران دوقطبی افسرده، الگوی vigilance بالایی نشان میدهند که تقریباً از افسردگی تک قطبی قابل تشخیص نیست. در مقابل، در دوره شیدایی، vigilance بسیار ناپایدار با تغییرات مکرر و افت سریع به سمت خواب آلودگی است. جالب است که بیماران شیدا حتی نسبت به افراد سالم نیز تغییرات vigilance بیشتری داشتند.
چگونه ممکن است فرد شیدا که ظاهراً "بیش از حد پرانرژی" است، مغزی کم فعال داشته باشد؟ مدل تنظیم vigilance این مسئله را اینگونه توضیح میدهد: شیدایی ممکن است ناشی از جبرانسازی بیش از حد مغز برای ناپایداری یا کمبود ذاتی vigilance باشد. بیماران شیدا اغلب گزارش میدهند که به خواب کمی نیاز دارند و همواره فعال هستند. نظریه این است که، رفتارهای جستجوی هیجان، فعالیت و بیقراری در شیدایی، تلاشهایی برای اجتناب از حالتهای vigilance کم است. به بیان دیگر، شیدایی ممکن است یک حرکت تصحیحی برای افت vigilance باشد. این علایم شبیه ADHD است و در واقع شیدایی و ADHD ویژگیهای بالینی مشترکی مانند حواس پرتی، بیش فعالی و تکانشگری دارند و شاید فیزیولوژی vigilance مشترکی نیز داشته باشند.
وقتی به انتخاب دارو در اختلال دوقطبی نگاه میکنیم، باید بین دورههای شیدایی و افسردگی تمایز قائل شویم، چون مدیریت آنها کاملاً متفاوت است. راهنمای درمان برای شیدایی حاد، داروهایی را توصیه میکند که تحریکپذیری عصبی را کاهش داده و تثبیتکننده خلق باشند، یعنی تثبیت کنندههای خلق (لیتیوم، والپروات) و/یا داروهای ضدروانپریشی میتوانند در این مرحله کمک کننده باشند. لیتیوم و والپروات دارای اثر ضدشیدایی گستردهای هستند و بسیاری از ضد روان پریشیهای آتیپیک (مثل اولانزاپین، ریسپریدون، کوئتیاپین) برای درمان شیدایی تایید شدهاند. این داروها رفتارهای بیش فعالانه را آرام کرده و خواب را تنظیم میکنند، و عملاً میل شیدایی را مهار میکنند. از دیدگاه vigilance، میتوان گفت که این داروها با کند کردن فعالیت مغز از طریق مصرف دارو، تثبیت خارجی vigilance را تحمیل میکنند. مثلاً، ضد روانپریشیها با مسدود کردن دوپامین و اثر آرام بخشیشان به مهار بیش فعالی شیدایی کمک میکنند. بنابراین، در بیمار شیدا با vigilance ناپایدار، تجویز ضد روان پریشی آرام بخش، این نوسانات سریع را مهار کرده و بیمار را در حالت آرام و پایدار نگه میدارد.
سؤال چالش برانگیزتر این است که آیا محرکها در درمان شیدایی نقشی دارند یا خیر؟ به طور سنتی، محرکها در شیدایی منع مصرف دارند چون ممکن است روان پریشی، بیخوابی و آشفتگی را تشدید کنند. اما Hegerl و همکاران (۲۰۰۹) فرض کردند که دوز کم محرک ممکن است بیمار را با افزایش سطح پایه vigilance و کاهش نیاز مغز به حرکت به سمت حالت شیدایی کامل، در شیدایی تثبیت کند. این رویکرد، کاملاً متفاوت از روش معمول است. به طور غیر رسمی، برخی بیماران دوقطبی که در مرحله افسردگی، محرک مصرف کردهاند، لزوماً وارد شیدایی نمیشوند و گاهی این امر میتواند ثبات کلی آنها را بهبود دهد. اما در حال حاضر هیچ راهنمای درمانی، استفاده از محرکها را برای شیدایی حاد تایید نمیکند و این موضوع همچنان آزمایشی است. شاید در آینده برای زیرگروهی از بیماران با ناپایداری مداوم vigilance، استفاده کنترل شده از داروهای محرک بیداری برای پیشگیری از سقوطهای افسردگی یا نوسانات شیدایی مورد آزمایش قرار گیرد.
در افسردگی دوقطبی، نمای vigilance اغلب بسیار پایدار است. بسیاری از بیماران دوقطبی افسرده دچار فلج عضلانی، خواب آلودگی بیش از حد و غیره هستند که نشان دهنده کاهش vigilance میباشد. راهنمای درمان افسردگی دوقطبی، بر مصرف ضد افسردگیهای تثبیت کننده خلق مانند لاموتریژین، آنتیسایکوتیک آتیپیک کوئتیاپین، یا درمانهای ترکیبی (لیتیوم یا ضدصرع به همراه ضد افسردگی) تاکید دارد. اگر بیمار دوقطبی افسرده نمایه vigilance کم فعال (خواب آلود، کند) داشته باشد، دارویی مانند کوئتیاپین ممکن است خستگی را بدتر کند. در چنین مواردی، پزشکان گاهی از افزایش محرک (غیر رسمی) یا استفاده از رژیمهای کم آرام بخشتر (مثلاً SSRIهای با دوز پایین یا بوپروپیون به همراه لیتیوم) استفاده میکنند. اگر EEG بیمار دوقطبی افسرده، افت سریع به مرحله پایین را نشان دهد، پزشک ممکن است تمایل به افزودن داروی محرک (مانند مودافینیل یا آرمودافینیل، که در افسردگی دوقطبی مورد مطالعه قرار گرفتهاند و در افزایش انرژی موفق بودهاند) داشته باشد. اگر vigilance بسیار پایدار باشد، تمرکز بر اطمینان از خواب کافی و شاید استفاده از آرام بخش شبانه (مانند بنزودیازپین با دوز پایین یا آنتیسایکوتیک آرام بخش) همراه با ضد افسردگی برای کاهش آشفتگی درونی خواهد بود.
درمانهای غیر دارویی مانند نور درمانی و درمان کمبود خواب نیز در افسردگی دوقطبی کاربرد دارند که اساساً از طریق تنظیم vigilance عمل میکنند (کمبود خواب به طور حاد هوشیاری را افزایش داده و میتواند افسردگی دوقطبی را موقتاً بهبود بخشد، در حالی که نور درمانی میتواند الگوهای شبانهروزی vigilance را تنظیم کند). این درمانها باید با احتیاط به کار روند تا از تحریک شیدایی جلوگیری شود، این امر نشان دهنده حساسیت بالای تعادل vigilance در اختلال دوقطبی است.
اختلال دوقطبی، نمونهای از نوسانات شدید vigilance است و درمان باید متناسب با وضعیت فعلی بیمار باشد. در شیدایی، کاهش و تثبیت vigilance کلیدی است که با تثبیت کنندههای خلق و ضد روان پریشیهای مرسوم انجام میشود. در افسردگی دوقطبی، درمان باید الگوهای پایدار یا کم فعال vigilance را هدف قرار دهد. این کار با استفاده از داروهایی که یا مغز تنش زده را آرام میکنند یا مغز کند و خسته را فعال میسازند صورت میگیرد.
اختلال پانیک با حملات ناگهانی و شدید اضطراب همراه است که اغلب با علائم فیزیولوژیکی مانند تپش قلب، تنگی نفس و ترس از مرگ مشخص میشود. از نظر پروفایل vigilance، بیماران مبتلا به اختلال پانیک معمولاً الگوهای EEG نشان دهنده hypervigilance یا افزایش پایدار سطح بیداری مغزی را بروز میدهند.
مطالعات EEG نشان میدهند که در این بیماران، توان مطلق در باندهای دلتا، تتا و آلفا افزایش یافته و توان نسبی در باند بتا کاهش مییابد. این امر بازتاب دهنده یک حالت vigilance بیش از حد و ناتوانی در رسیدن به مراحل پایینتر vigilance است. این پروفایل مشابه اختلالات اضطرابی دیگر است، اما در پانیک، نوسانات vigilance ممکن است با حملات حاد همراه باشد.
از نظر پیش آگهی درمانی، شاخصهای vigilance بالا در بیماران پانیک پیش بینی کننده پاسخ خوب به درمانهای استاندارد است. بیمارانی که vigilance پایدار و بالایی دارند، اغلب از داروهای SSRI (مانند سرترالین یا پاروکستین) یا SNRI بهره میبرند. زیرا این داروها میتوانند hyperarousal را کاهش داده و حملات پانیک را کنترل کنند. دستورالعملهای بالینی (مانند APA) SSRIها را به عنوان خط اول برای اختلال پانیک توصیه میکنند. همچنین، مطالعات نشان میدهد که کاهش vigilance در طول درمان با بهبود علائم همبستگی دارد. اگر پروفایل vigilance نشان دهنده نوسانات شدید باشد (مانند افزایش ناگهانی در حملات)، ممکن است افزودن بنزودیازپینهای کوتاه اثر (مانند آلپرازولام) برای کنترل حاد لازم باشد، اما باید با توجه به دلیل خطر وابستگی با احتیاط تجویز شوند.
در موارد مقاوم، اگر vigilance پایینتر از حد انتظار (مانند خستگی پس از حمله) مشاهده شود، درمانهای فعالکننده مانند بوسپیرون یا حتی مودافینیل میتواند مفید باشند، تا با تجویز آنها، تعادل بیداری در بیمار حفظ شود.
در کودکان و نوجوانان مبتلا به پانیک، پروفایل vigilance میتواند به تمایز از سایر اختلالات کمک کند و درمان را به سمت SSRI های ایمن (مانند فلوکستین) هدایت نماید. به طور کلی، vigilance بالا در پانیک بر نیاز به درمانهای کاهش دهنده arousal تأکید دارد و میتواند فرآیند انتخاب دارو را شخصی سازی کند.
اختلال وسواسی-جبری (OCD) با افکار مزاحم و رفتارهای تکراری مشخص میشود که اغلب با اضطراب و تنش درونی همراه است. پروفایل vigilance در بیماران OCD معمولاً نشان دهنده یک تنظیم تغییر یافته است. به طوری که بیماران در حالت استراحت نمیتوانند به مراحل پایین vigilance برسند و تمایل به باقی ماندن در مراحل بالا (hyperstable) دارند.
مطالعات EEG نشان میدهند که OCD با افزایش توان در نواحی فرونتال و کاهش کوهرنس غیر خطی در باند بتا همراه است، که این امر، بازتاب دهنده ناتوانی در آرام سازی مغز و حفظ vigilance بیش از حد است. این پروفایل با علائم بالینی مانند نشخوار فکری و ناتوانی در خاموش کردن افکار وسواسی همخوانی دارد و اختلال OCD را از BPD (اختلال شخصیت مرزی) که vigilance ناپایدارتری دارد، تمایز میدهد.
از منظر پیش آگهی درمانی، vigilance پایدار و بالا در OCD پیش بینی کننده پاسخ به درمانهای سرتونرژیک است. بیمارانی با این پروفایل اغلب به SSRIها (مانند فلووکسامین یا سرترالین با دوز بالا) پاسخ خوبی میدهند. زیرا این داروها میتوانند hypervigilance را کاهش دهند و چرخه وسواس-اجبار را بشکنند. دستورالعملهای بالینی OCD را با SSRI ها یا کلومیپرامین (TCA) به عنوان خط اول درمان میکنند، و مطالعات نشان میدهند که کاهش vigilance در طول درمان با بهبود علائم همبستگی دارد. اگر پروفایل vigilance نشان دهنده نوسانات باشد (مانند در موارد همراه با اضطراب شدید)، افزودن آنتی سایکوتیک های آتیپیک (مانند ریسپریدون) میتواند مفید باشد.
در موارد مقاوم، اگر vigilance پایینتر مشاهده شود (مانند خستگی ناشی از اجبارها)، درمانهای فعال کننده مانند افزودن محرکها (با احتیاط) یا ERP (روان درمانی مواجهه) میتواند در نظر گرفته شود.
در کودکان و نوجوانان OCD، پروفایل vigilance میتواند به تشخیص زودرس کمک کند و درمان را به سمت SSRI های ایمن هدایت نماید. به طور خلاصه، hyperstable vigilance در OCD بر تمرکز بر درمانهای کاهش دهنده arousal تأکید دارد و میتواند به شخصی سازی درمان کمک کند.
دمانس، به ویژه آلزایمر، با زوال شناختی پیشرونده همراه است که اغلب با اختلال در تنظیم vigilance ظاهر میشود. پروفایل vigilance در بیماران دمانس معمولاً نشان دهنده کاهش کلی بیداری مغزی(low vigilance) است، و عموماً با EEG کندتر، افزایش توان در باندهای دلتا و تتا، و کاهش توان در آلفا و بتا مشاهده میشود. این الگو بازتاب دهنده dysfunction قشری و ناتوانی در حفظ vigilance بالا است، که با علائمی مانند گیجی، خواب آلودگی روزانه و کاهش توجه همخوانی دارد. مطالعات نشان میدهند که در دمانس با اجسام لویی (DLB) و پارکینسون (PDD)، EEG slowing نسبت به آلزایمر شدیدتر است.
از نظر پیش آگهی درمانی، vigilance پایین در دمانس پیش بینی کننده پیشرفت بیماری است و میتواند مسیر درمانهای حمایتی را هدایت کند. بیمارانی با این پروفایل، اغلب از مهار کنندههای کولیناستراز (مانند دونپزیل یا ریواستیگمین) بهره میبرند، زیرا این داروها میتوانند بیداری قشری را تا حدی افزایش دهند و علائم شناختی را بهبود بخشند. دستورالعملهای بالینی، این داروها را به عنوان خط اول برای آلزایمر توصیه میکنند، همچنین مطالعات EEG نشان میدهد که بهبود vigilance با پاسخ درمانی همبستگی دارد. اگر پروفایل vigilance نشان دهنده نوسانات شدید باشد (مانند DLB)، افزودن داروهای آنتی سایکوتیک (مانند کوئتیاپین) باید با احتیاط بیشتری، به منظور کنترل علائم روان پریشی تجویز شوند.
در موارد پیشرفته، اگر vigilance بسیار پایین باشد، درمانهای فعال کننده مانند مودافینیل برای خواب آلودگی روزانه میتواند در نظر گرفته شود، اما با تمرکز بر ایمنی سالمندان.
در مراحل اولیه، پروفایل vigilance میتواند به تشخیص زودرس کمک کند و درمان را به سمت مداخلات غیر دارویی (مانند تحریک شناختی) هدایت نماید. به طور کلی،vigilance پایین در دمانس بر نیاز به درمانهای افزایش دهنده بیداری تأکید دارد و میتواند فرآیند مدیریت بیماری را شخصی سازی کند.

برای نشان دادن اینکه چگونه پروفایلهای vigilance میتوانند راهنمایی برای تصمیم گیری دارویی باشند، به نمونههای فرضی زیر توجه کنید:
مردی ۳۵ ساله، با افسردگی اساسی که دچار بیخوابی، نشخوار ذهنی مداوم و اضطراب شده است را در نظر بگیرید. او میگوید احساس «خستگی همراه با تنش» دارد. QEEG در حالت چشم بسته به مدت ۱۵ دقیقه، یک پروفایل فوقالعاده پایدار از vigilance را نشان میدهد. مغز بیمار تقریباً تمام مدت در مرحلههای vigilance بالا باقی میماند و تقریباً هیچگونه گذار به مراحل پایینتر ندارد. این الگو با دشواری او در استراحت هماهنگ است.
بر اساس vigilance، روانپزشک سرترالین (یک SSRI) را به عنوان درمان خط اول انتخاب میکند، و انتظار دارد این دارو در طول چند هفته به کاهش تحریک پذیری بیش از حد او کمک کند. چون پروفایل vigilance بیمار نشان دهنده بیداری بیش از حد است، پزشک همچنین دوز پایین میرتازاپین را شبها برای بهره گیری از اثر آرام بخش آن و کمک به تنظیم مجدد خواب تجویز میکند (زیرا افراد با vigilance پایدار اغلب در به خواب رفتن مشکل دارند). پس از ۴ تا ۶ هفته، نمرات HAM-D بیمار تا ۶۰٪ بهبود مییابند. QEEG بعدی نشان میدهد که اکنون، مغز بیمار وارد مرحله vigilance آرام و حتی گاهی مرحله خواب آلودگی نیز میشود، که با گزارش او مبنی بر احساس آرامش بیشتر و توانایی خوابیدن راحتتر هماهنگ است.
این مورد نشان میدهد که شناسایی الگوی vigilance بیش از حد پایدار منجر به استفاده از ضد افسردگی با خاصیت ضد اضطراب و افزودن آرام بخش در شب شد، و این ترکیب به بهبود نتیجه درمان کمک کرد.
پسر ۹ سالهای با ADHD نوع عمدتاً بیتوجه را نظر بگیرید. او در کلاس خیال پردازی میکند و اغلب خوابآلود یا منگ به نظر میرسد. ارزیابی vigilance او نشان میدهد که به سرعت و مکرراً به مراحل هوشیاری پایین سقوط میکند. پس از چند دقیقه نشستن بیحرکت، مغز بیمار به مرحله B2/3 میرود و امواج تتای خواب آلودگی ظاهر میشوند. این ناپایداری vigilance، وجود برانگیختگی پایین در مغز را که به اختلال در تمرکز منجر میشود تأیید میکند.
بر اساس راهنماهای درمانی ADHD و یافتههای QEEG، روانپزشک داروی محرک متیلفنیدیت را آغاز میکند. همان طور که انتظار میرود، دارو موجب افزایش سطح برانگیختگی مغزی بیمار میشود. یک ماه بعد، معلمش گزارش میدهد که او مدت بیشتری روی تکالیف متمرکز میماند و کمتر در رویا فرو میرود. از منظر QEEG، سطح متوسط vigilance او افزایش یافته و دفعات سقوط عمیق به مرحله B کاهش یافتهاند که نشانهای از اثر بخشی دارو است.
علاوه بر این، چون همچنان افت توجه در ساعات پایانی روز وجود دارد، پزشک دوز کوچکی از دارو را، مجدداً بر اساس آگاهی از الگوی طبیعی کاهش vigilance او برای بعد از ظهر تجویز میکند.
مورد این بیمار، یک سناریوی کلاسیک را نشان میدهد، EEG با vigilance ناپایدار بهطور مستقیم تصمیم گیری برای استفاده از محرکها را تأیید میکند، و QEEG حتی به تنظیم دقیق زمان بندی دوز کمک میکند.
دختر ۱۶ سالهای با اختلال اضطراب فراگیر (GAD) داریم که از نگرانی دائمی و خواب ضعیف شکایت دارد. اغلب بیقرار است و ذهنش هنگام خوابیدن به شدت فعال است. QEEG او فعالیت امواج سریع را نشان میدهد و تقریباً هیچ گونه کندشدگی آلفا در طول ثبت دیده نمیشود. به عبارتی، EEG او نشانهای از یک مغز بیش هشیار دارد. حتی با چشمان بسته، مغزش به راحتی وارد الگوهای آرام نمیشود، که با مشکل او در آرام گرفتن مطابقت دارد.
مطابق با راهنماهای درمان اضطراب کودکان، روانپزشک او اسیتالوپرام (SSRI) را برای کاهش اضطراب پایهای آغاز میکند. پروفایل vigilance همچنین، به پزشک هشدار میدهد که باید بیخوابی و برانگیختگی زیاد او را نیز هدف قرار دهد. به او توصیههایی برای بهداشت خواب و تکنیکهای آرام سازی شبانه داده میشود، و دوز پایینی از هیدروکسیزین (آنتیهیستامین با خاصیت ضد اضطراب).
طی ۱۰ هفته، علائم نگرانی بیمار به طور چشمگیری کاهش مییابد. خواب او با بهبود عادات بهتر شده و فقط گاه به گاه به هیدروکسیزین نیاز دارد. EEG بعدی نیز، دورههایی از فعالیت آلفای منظم را هنگام بسته بودن چشمها نشان میدهد و مغز او اکنون میتواند وارد مرحلهای آرامتر از vigilance شود (A2/A3) ، که قبلاً به ندرت رخ میداد.
این مورد نشان میدهد که شناسایی الگوهای بالای vigilance در اضطراب، منجر به یک برنامه جامع شد.SSRI مطابق با راهنماها، برای درمان اضطراب اصلی، به علاوه اقدامات مکمل برای هدف قرار دادن مستقیم برانگیختگی زیاد (بهبود خواب و استفاده از آرام بخش غیر معتاد).
"مراجعه کننده، مردی ۲۸ ساله با اختلال دوقطبی نوع I است که در حال حاضر در فاز شیدایی قرار دارد. او انرژی بیپایانی دارد، تنها ۳ ساعت در شب میخوابد و مدام در حال قدم زدن یا صحبت کردن است.QEEG در حالت چشمان بسته برای مدت کوتاه، الگوی بسیار ناپایداری از vigilance را نشان میدهد. به محض نشستن آرام، EEG او جهشهای ناگهانی به امواج تتا و حتی چند موج تیز نشان میدهد (نشانههایی از نفوذ خواب)، که بلافاصله با بازکردن چشم یا حرکت فیزیکی قطع میشود. این حالت با مدلی از برانگیختگی هماهنگ است که در آن پرتحرکی بیمار مانع از ورود او به وضعیت آرامش میشود.
تیم درمانی که میداند راهنماها توصیه به آرام سازی سریع و تثبیت خلق دارند، هالوپریدول عضلانی (ضد روان پریشی) را برای آرام سازی حاد تجویز میکند و درمان با لیتیوم برای تثبیت خلق آغاز میشود. طی یک هفته، شیدایی بیمار فروکش میکند. او ۶–۷ ساعت در شب میخوابد و دیگر مدام راه نمیرود.QEEG بعدی هنوز مقداری نوسان در vigilance را نشان میدهد، اما بسیار پایدارتر است. او میتواند چند دقیقه چشمانش را بسته نگه دارد و فعالیت آلفا داشته باشد، درحالیکه قبلاً حتی ۱۰ ثانیه هم نمیتوانست.
بیمار به طور بلند مدت روی لیتیوم باقی میماند. این مورد تأکید میکند که هرچند مسئله اصلی بیمار ناپایداری برانگیختگی بود، مداخلاتی که فعالیت عصبی را کاهش میدهند (ضد روان پریشی، لیتیوم) مؤثر واقع شدند.QEEG، حالت اولیه ناپایدار و بهبود آن را تأیید کرد، که تصمیم برای استفاده از داروهای ضد شیدایی استاندارد را تقویت کرد.

ارزیابی و کاربردvigilance در روانپزشکی بالینی، به عنوان یک بیومارکر نوروفیزیولوژیک کلیدی، پلی بین علائم subjective بیماران و مکانیسمهای زیستی اختلالات روانی ایجاد میکند. همان طور که در این مقاله بررسی شد، vigilance نه تنها به تمایز مفاهیم مرتبط مانند arousal و attention کمک میکند، بلکه با استفاده از روشهای سنجش پیشرفته مانند QEEG، امکان کمّی سازی دقیق تنظیم هوشیاری مغز را فراهم میآورد.
پروفایلهایvigilance در اختلالاتی نظیر افسردگی (با الگوی hyperstable)،ADHD (با ناپایداری)، اضطراب (با hyperarousal)، بیخوابی و اختلال دوقطبی (با نوسانات وابسته به وضعیت) نقش محوری دارند و میتوانند پیش بینی کننده پاسخ به درمان باشند. مطالعات موردی نشان دادند که ادغام این شاخصها با علائم بالینی، درمان را شخصی سازی کرده و از فرآیند آزمون و خطا کاسته، منجر به انتخاب هدفمند داروها میشود.
در عصری که روانپزشکی به سوی پزشکی دقیق حرکت میکند، ابزارهایی مانند گزارشهای QEEGhome ارزشمند هستند و امکان پیگیری تغییراتvigilance در طول درمان را فراهم میآورند. با این حال، این رویکرد باید به عنوان مکملی برای راهنماهای بالینی استاندارد استفاده شود و با ملاحظات ایمنی همراه باشد.
در نهایت، vigilance یادآوری میکند که اختلالات روانی، اغلب ریشه در تنظیم پایهای هوشیاری مغز دارند و با ابزارهای عینی مانند EEG، میتوان فراتر از علائم، به هسته زیستی این اختلالات نفوذ کرد.
Klösch, G., et al. (2