
اختلال OCD یکی از شایعترین اختلالات روانی است که میلیونها نفر در سراسر جهان را تحت تأثیر قرار میدهد. بر اساس آمارهای معتبر، شیوع این اختلال در طول زندگی افراد حدود ۱ تا ۳ درصد تخمین زده میشود (1)، به طوری که تقریباً ۱ نفر از هر ۴۰ بزرگسال و ۱ نفر از هر ۱۰۰ کودک و نوجوان ممکن است به آن مبتلا شوند (2). علائم OCD معمولاً شامل وسواسهای فکری ناخواسته مانند ترس از آلودگی، شک و تردید مداوم، یا نیاز به نظم و تقارن، و اجبارهای عملی مانند شستشوی مکرر دستها، بررسیهای تکراری، یا رفتارهای ritualistic برای کاهش اضطراب میشود (3). این علائم نه تنها باعث ایجاد پریشانی شدید میشوند، بلکه تأثیرات عمیقی بر زندگی روزمره بیماران میگذارند؛ به عنوان مثال، حدود ۵۰ درصد از بزرگسالان مبتلا به OCD دچار اختلال جدی در عملکرد روزانه میشوند، ۳۵ درصد اختلال متوسط و ۱۵ درصد اختلال خفیف را تجربه میکنند (1). علاوه بر این، OCD میتواند منجر به افسردگی، اضطراب مزمن، مشکلات روابط اجتماعی و حتی اختلال در کار یا تحصیل شود (4)، به گونهای که بیش از ۷۶ درصد افراد مبتلا گزارش میدهند که این بیماری تأثیر قابل توجهی بر کیفیت زندگیشان داشته است (5).
اهمیت تشخیص دقیق اختلال OCD نمیتواند اغراق آمیز باشد، زیرا این اختلال اغلب دیر تشخیص داده میشود یا با بیماریهای دیگر اشتباه گرفته میشود، که منجر به تأخیر در درمان مناسب و افزایش رنج بیماران میگردد (6). تشخیص نادرست OCD میتواند عواقب جدی مانند توسعه سایکوز، تمایلات خودکشی و کاهش کیفیت زندگی را به همراه داشته باشد (7). تمایز OCD از اختلالات مشابه مانند اختلال GAD، MDD، ADHD و حتی برخی اختلالات طیف اوتیسم ضروری است، زیرا علائم همپوشانی مانند نگرانیهای تکراری، رفتارهایritualistic یا مشکلات تمرکز میتواند پزشکان را به اشتباه بیندازد (3). این تشخیص افتراقی نه تنها به انتخاب درمان صحیح کمک میکند، بلکه از عوارض جانبی درمانهای نامناسب جلوگیری مینماید و مسیر بهبودی را تسریع میبخشد (6).
روشهای سنتی تشخیص OCD عمدتاً بر پایه ارزیابیهای بالینی استوار است، که شامل مصاحبههای نظام مند با بیمار، بررسی تاریخچه پزشکی، و استفاده از معیارهای تشخیصی مانند DSM-5 میشود (3). ابزارهایی مانند مقیاس Yale-Brown Obsessive Compulsive Scale (Y-BOCS) برای ارزیابی شدت علائم وسواس و اجبارها به کار میرود، که بر اساس گزارشهای خود بیمار یا مشاهدههای بالینی عمل میکند (8). با این حال، این روشها subjective هستند و وابسته به گزارشهای بیمار، که ممکن است تحت تأثیر عوامل فرهنگی، شرم، یا عدم آگاهی قرار گیرد، و بنابراین دقت آنها محدود است (6).
در مقابل، روشهای Objective نوین مانند تصویر برداری عصبی (مانندfMRI ) و به ویژه الکتروانسفالوگرافی کمّی (QEEG) در سالهای اخیر نقش پررنگی در تشخیص دقیق OCD ایفا کردهاند. QEEG، که الگوهای فعالیت الکتریکی مغز را به صورت کمّی اندازه گیری میکند، میتواند تفاوتهای قابل توجهی در فعالیت مغزی افراد مبتلا به OCD نشان دهد (9). این روش نه تنها به تشخیص افتراقی کمک میکند (مانند تمایز OCD از ADHD)، بلکه در پیش بینی پاسخ به درمانهای دارویی یا روان درمانی، و حتی شخصی سازی درمانها مانند نوروفیدبک مؤثر است. با استفاده ازQEEG ، پزشکان میتوانند درمان را بر اساس الگوهای مغزی منحصر به فرد هر بیمار تنظیم کنند، که این امر دقت و کارایی فرآیند درمانی را به طور قابل توجهی افزایش میدهد (9).
یکی از روشهای نوین و عینی که در تشخیص و ارزیابی OCD نقش برجستهای ایفا میکند، الکتروانسفالوگرافی کمّی (QEEG) است. QEEG با اندازه گیری فعالیت الکتریکی مغز به صورت کمّی، الگوهای مغزی مرتبط با OCD را شناسایی میکند و میتواند بیومارکرهای الکتروفیزیولوژیکی ارزشمندی ارائه دهد که نه تنها به تشخیص کمک میکنند، بلکه در پیش بینی پاسخ به درمان و شخصی سازی رویکردهای درمانی مؤثر هستند (9). با این حال، یافتههای QEEG در بیماران OCD اغلب ناهمگون هستند؛ برخی مطالعات افزایش فعالیت در باندهای فرکانسی خاص را گزارش میکنند، در حالی که دیگران کاهش آنها را نشان میدهند، که این ناهمگونی میتواند ناشی از تفاوتهای زیر گروههای (مانندobsessive vs compulsive )، متدولوژی مطالعات، یا عوامل فردی مانند سن و شدت علائم باشد (10).
در سطح پیچیدگی سیگنالهایEEG ، مطالعات نشان دهنده کاهش entropy در بیماران OCD هستند. برای مثال، کاهش Approximate Entropy (ApEn)، Sample Entropy (SampEn) و Permutation Entropy (PermEn) در نواحی frontal و temporal (مانند Fp1, Fp2, F8, F7, T3) مشاهده شده است، که این تغییرات میتواند به طبقه بندی دقیق بیماران با دقت بیش از ۷۰ درصد کمک کند. این کاهش entropy نشان دهنده کاهش پیچیدگی سیگنالهای مغزی و احتمالاً اختلال در پردازش اطلاعات در مدارهای مرتبط با OCD است (11).
در تحلیل میکرواستیتها (microstates)، که الگوهای پایدار فعالیت EEG را توصیف میکنند، بیماران OCD اغلب کاهش مدت زمان میکرواستیت D (مرتبط با شبکه توجه پشتی) و افزایش سهم میکرواستیت C (مرتبط با شبکه برجستگی) را نشان میدهند، که این تغییرات با اختلال در شبکههای استراحتی مغز همخوانی دارد (12).
در مورد قدرت مطلق و نسبی باندهای فرکانسی، یافتهها متنوع و مغایر هستند:
Delta: افزایش قدرت مطلق دلتا در نواحیParietal/Occipital (مانند P3-O1 ,Fp1-F3) و پیشانی گزارش شده است، همراه با افزایش قدرت نسبی در نواحی قدامی و خلفی. همچنین، افزایش عدم تقارن قدرت نسبی دلتا در نواحی frontal و temporal (F3/F4 ,F7/F8 ,T3/T4 T5/T6) مشاهده میشود، که این میتواند نشان دهنده فعالیت بیش از حد در مدارهای subcortical مرتبط با اضطراب باشد (13،14).
Theta: افزایش قدرت مطلق تتا در نواحی Parietal/Occipital (P3-O1)، frontal و Frontotemporal شایع است، در حالی که کاهش قدرت مطلق تتا ۲ در نواحی Anterior گزارش شده. افزایش قدرت نسبی تتا در نواحی Frontotemporal و عدم تقارن نسبی در نواحی frontal و temporal نیز دیده میشود، که این تغییرات با افزایش قدرت نوسانی دلتا و تتا همخوانی دارد اما با کاهش اتصال دلتا همراه است (13،14،15).
Alpha: افزایش قدرت مطلق آلفا در نواحی Parietal/Occipital و frontal در برخی مطالعات، اما کاهش قدرت مطلق و نسبی آلفا ۱ و ۲ در نواحی Anterior و Posterior در دیگر مطالعات ذکر شده است. همچنین، کاهش عدم تقارن قدرت نسبی آلفا در نواحی frontal و temporal مشاهده میشود، که ممکن است به اختلال در آرام سازی مغزی اشاره کند (16).
:Betaافزایش قدرت مطلق بتا در نواحی Parietal/Occipital و frontal در زیرگروههای obsessiveو compulsive، اما کاهش قدرت مطلق بتا، بتا ۱ و بتا ۲ در نواحی frontal و Frontotemporal در مطالعات دیگر بیان شده است. کاهش پیچیدگی باند بتا میتواند نشان دهنده مقاومت به درمان باشد. علاوه بر آن، افزایش Kolmogorov Family Dimension (KFD) بتا در نواحی frontal (F7, F3, Fz, F4) گزارش شده است (14،16).
Gamma: افزایش قدرت مطلق گاما در نواحی Parietal/Occipital و frontal، همراه با افزایش KFD گاما در نواحی frontal (F7, F3, Fz) اشاره شده است. که این میتواند به فعالیت بیش از حد cortical در پردازش وسواسها مرتبط باشد (14).
این ناهمگونی در بیومارکرها تأکید میکند که OCD یک اختلال هتروژن است و QEEG میتواند برای شناسایی زیرگروهها و پیش بینی پاسخ به درمان (مانند درمان مقاوم) مفید باشد، اما نیاز به مطالعات بیشتر برای استانداردسازی وجود دارد.
با وجود ارزشمندی بیومارکرهای QEEG در ارزیابی OCD، ناهمگونی قابل توجه در این مارکرها میتواند چالشهای جدی برای پزشکان، بالینگران و روانپزشکان ایجاد کند (17). این ناهمگونی، که اغلب از تفاوتهای زیرگروههای OCD (مانند obsessive در مقابل compulsive)، روش شناسیهای متفاوت مطالعات، یا عوامل فردی مانند سن، شدت علائم و comorbid disorders ناشی میشود، ممکن است منجر به سردرگمی در تفسیر نتایج شود و دقت تشخیص را کاهش دهد (18). برای مثال، در حالی که برخی مطالعات افزایش قدرت دلتا و تتا را گزارش میکنند، دیگران کاهش فعالیت در باندهای آلفا یا بتا را نشان میدهند، که این تناقضات میتواند پزشکان را در تمایز OCD از اختلالات مشابه مانند اضطراب عمومی یا ADHD با مشکل مواجه کند و در نهایت به تأخیر در درمان مناسب یا انتخاب رویکردهای ناکار آمد منجر شود (17،19). این مسئله لزوم نیاز به ابزارهای تحلیلی پیشرفتهتر را آشکار میسازد، که بتواند این ناهمگونی را مدیریت کند و الگوهای منحصر به فرد هر بیمار را به طور دقیق شناسایی نمایند (20).
در روشهای سنتی تحلیل QEEG، نرمافزار NeuroGuide اغلب به عنوان ابزار اصلی مورد استفاده قرار میگیرد، که عمدتاً بر پایه مقایسه دادههای بیمار با پایگاه داده normative و محاسبه معیارهای فرکانسی مرسوم مانند قدرت مطلق و نسبی، coherence، phase lag و Z-scores سازی آنها عمل میکند (20). با این حال، این نرمافزار هیچ کمکی در رابطه با مدیریت ناهمگونی مارکرها، استفاده از مارکرهای نوین و یا ترکیب مارکرها را ارائه نمیدهد و مشکلات عدیدهای دارد، از جمله وابستگی بیش از حد به پایگاه دادههای محدود که ممکن است تنوع فرهنگی یا سنی را به طور کامل پوشش ندهد، و عدم توانایی در ادغام عوامل پویا مانند تغییرات زمانی در فعالیت مغزی. علاوه بر آن، یکی از بزرگترین ضعفهای NeuroGuide، عدم پشتیبانی از مارکرهای غیر خطی است (21). این مارکرها میتوانند اطلاعات ارزشمندی در مورد پیچیدگی و دینامیک غیر خطی سیگنالهای مغزی ارائه دهند و در تشخیص بهینه OCD بسیار کمک کننده باشند. عدم بررسی این مارکرهای غیر خطی توسط NeuroGuide یک ضعف بزرگ محسوب میشود، زیرا مطالعات اخیر نشان میدهند که کاهش entropy و complexity در نواحی frontal و temporal میتواند بیومارکرهای الکتروفیزیولوژیکی قوی برای تمایز OCD از افراد سالم باشد، و ادغام آنها میتواند دقت طبقهبندی را به بیش از ۸۰ درصد برساند (21). این محدودیتها NeuroGuide را به ابزاری ناکافی برای تحلیلهای پیشرفته تبدیل میکند، به ویژه در مواردی که ناهمگونی مارکرها برجسته است، و نیاز به رویکردهای نوینتر را برجسته میسازد (20،21).
با توجه به چالشهای موجود در تحلیل سنتیQEEG ، نیاز به راهکارهای نوین برای افزایش کاربرد بالینی QEEG بیش از پیش احساس میشود. شرکت QEEGhome، به عنوان یک پلتفرم پیشرو در تحلیل الکتروانسفالوگرافی کمّی، متوجه این خلأ شده و با تمرکز بر ارتقای دقت تشخیصی و درمانی، رویکردی نوآورانه اتخاذ کرده است.
یکی از ابتکارات کلیدی این شرکت، افزودن صفحات "پاتولوژیک-محور " (Pathology-specific Pages) به گزارشهای QEEG است، که این صفحات با ادغام همزمان مارکرهای فرکانسی مانند قدرت مطلق و نسبی باندهای فرکانسی، coherence و مارکرهای غیر خطی مانند entropy، complexity measures و تحلیل میکرواستیتها طراحی شدهاند تا ناهمگونیها را مدیریت کنند و اطلاعات جامعی ارائه دهند.
این صفحات با بررسی تشخیصهای افتراقی (DDX) بیماریها و مارکرهای مرتبط با آنها، از جمله OCD، به روانپزشکان کمک میکنند تا علاوه بر تشخیص اصلی، به ارزیابی comorbidityها (مانند هم آیندی OCD با اضطراب، افسردگی یا ADHD) بپردازند. استفاده همزمان از دادههای خطی و غیر خطی در این سیستم، که بر پایه الگوریتمهای یادگیری ماشین آموزش دیده و بر دادههای ایرانی فاقد مداخله دارویی استوار است، دقت تشخیص را افزایش میدهد و مسیر شخصی سازی درمان را تسهیل میکند. در ادامه این مقاله، به بررسی مفصلتر صفحه پاتولوژیک OCD و صفحات دیگر این ریپورت و نقش آنها در بالین خواهیم پرداخت.
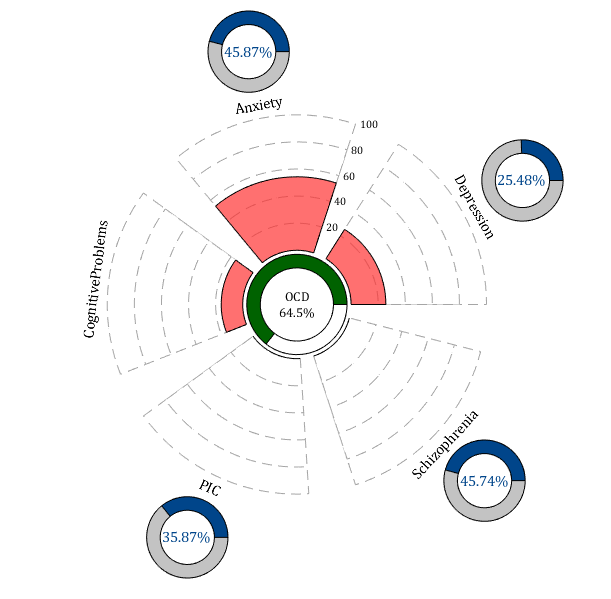
صفحه پاتولوژیک OCD در سیستم گزارشهای QEEGhome ابزاری پیشرفته برای مدیریت پیچیدگیهای تشخیص افتراقی (DDX) و هم آیندیها (Comorbidity) در این اختلال است. همانطور که در مطالعات اخیر نشان داده شده است، OCD اغلب با علائم متفاوتی مانند افکار وسواسی مزاحم، رفتارهای اجباری تکراری، و اضطراب شدید همراه است که میتواند با اختلالات مشابه مانند افسردگی اساسی (MDD)، اضطراب فراگیر (GAD)، اختلال کمبود توجه و بیش فعالی (ADHD)، و حتی اسکیزوفرنی هم پوشانی داشته باشد. این هم پوشانی میتواند تشخیص را پیچیده کند. افزون بر این، وجود هم آیندیهایی مانند پانیک میتواند به تفسیر نادرست منجر شود.
صفحه پاتولوژیک QEEGhome با تکیه بر الگوریتمهای یادگیری ماشین و دادههای الکتروفیزیولوژیکی، این ناهمگونیها را مدیریت میکند. این صفحه با استفاده از نورومارکرهای متعدد و مقایسه پروفایل بیمار با دیتابیس ایرانی فاقد مداخله دارویی، احتمال حضور OCD و هم آیندیهای احتمالی مانند MDD، اضطراب یا اسکیزوفرنی را به صورت کمّی ارائه میدهد. نمودارهای این صفحه، که در بالا آورده شده است، به صورت دایرهای طراحی شدهاند و احتمال هر تشخیص افتراقی را نشان میدهند.
برای استفاده از این صفحه، روانپزشک میتواند به شرح زیر عمل کند:
ابتدا، نمودار مرکزی را بررسی کند که احتمال تشخیص اصلی (در اینجا ۵۷.۲۹٪ برای OCD) را نشان میدهد. این مقدار به عنوان پایه تشخیص اولیه در نظر گرفته میشود.
سپس، دایرههای جانبی را تحلیل کند که احتمال تشخیصهای افتراقی (مانند MDD با ۲۵٪ یا اسکیزوفرنی با ۳۳.۷۸٪) را نشان میدهند.
در نمودار همبودیها، قطاعهای صورتی شدت و احتمال همزمانی علائم را نشان میدهند: برای مثال در این نمودر «اضطراب» بزرگترین سهم را دارد و بار همبودیِ غالب را نمایش میدهد. در قطاع دیگر نمودار depression مشاهده میشود که در حدود 25 درصد همبودی را نشان میدهد که قابل توجه است. آنالیز دادههای این بیمار همچنان ریسک مشکلات شناختی در حد 15 الی 20 درصد نشان میدهد که میتواند زنگ خطر برای بیماریهای شناختی در آینده باشد و میتواند پزشک را در رابطه با تحت نظر قرار دادن بیمار برای جلوگیری از بیماری های شناختی در اینده گوش به زنگ نگه دارد.
در نهایت، با توجه به توضیحات مراجعهکننده، که علائم بالینی مانند حملات پانیک یا رفتارهای آیینی را با الگوهای QEEG مرتبط میکند، تشخیص نهایی را تنظیم کند. این رویکرد به پزشک کمک میکند تا از خطاهای تشخیصی مانند اشتباه گرفتن OCD با افسردگی صرف یا ADHD جلوگیری کرده و درمان را با در نظر گرفتن کل تابلوی بالینی شخصیسازی کند.
این روش، با ادغام دادههای خام QEEG و تحلیل هوش مصنوعی، نه تنها دقت تشخیص را افزایش میدهد، بلکه به روانپزشکان امکان میدهد تا با اطمینان بیشتری به مدیریت بیماران مبتلا به OCD و هم آیندیهای آن بپردازند.
یکی از شاخصهای کلیدی در تحلیل QEEG که میتواند اطلاعات ارزشمندی در مورد عملکرد مغزی ارائه دهد، Alpha Peak Frequency (APF) است. APF به فرکانس غالب در باند آلفا اشاره دارد که در EEG اندازه گیری میشود و نشان دهنده سرعت نوسانات مغزی در حالت استراحت است. این شاخص اغلب در شرایط چشمان بسته (Eyes Closed) و چشمان باز (Eyes Open) ارزیابی میشود و میتواند با عملکرد شناختی، توجه، و حالات عاطفی مرتبط باشد.
مقدار نرمال APF بسته به سن متفاوت است و با رشد و پیری تغییر میکند. این تغییرات نشان دهنده بلوغ سیستم عصبی در کودکی و کاهش کارایی شناختی با پیری است(17).
تغییرات APF در نواحی anterior و posterior مغز معانی متفاوتی دارند. معمولاً یک گرادیان منفی از posterior به anterior وجود دارد، به طوری که APF در posterior بالاتر و در anterior پایینتر است، که این نشان دهنده توزیع طبیعی فعالیت آلفا در مغز است. افزایش APF (بالاتر از نرمال) میتواند با عملکرد شناختی بهتر، هوش بالاتر، یا حالات اضطرابی و بیش فعالی مرتبط باشد، در حالی که کاهش APF (پایینتر از نرمال) اغلب با اختلالات شناختی، افسردگی، پیری زودرس، یا مشکلات توجه همراه است. در نواحی anterior، کاهش APF ممکن است به نقص در کنترل اجرایی و تصمیم گیری اشاره کند، در حالی که درposterior ، کاهش آن میتواند با مشکلات پردازش بصری و آرام سازی مغزی مرتبط باشد (23).
در بیماران مبتلا به OCD، تغییرات APF اغلب ناهمگون است، اما مطالعات نشان میدهند که APF ممکن است کمی بالاتر از نرمال باشد، که این میتواند با افزایش فعالیت در باندهای کندتر (مانند تتا و دلتا) در نواحی frontotemporal همراه باشد و نشان دهنده اختلال در کنترل impulse و اضطراب مزمن باشد. با این حال، در برخی موارد، کاهش APF در نواحی posterior مشاهده میشود که با شدت علائم وسواسی مرتبط است.

در ادامه بررسی ها در تشخیص و ارزیابی OCD از طریقQEEG ، به شاخص سطح برانگیختگی (Arousal Level) میرسیم. سطح برانگیختگی به سطح هوشیاری، بیداری و فعال سازی مغز اشاره دارد و نشان دهنده تعادل بین حالات آرامش (مانند خواب یا استراحت) و هیجان (مانند توجه شدید یا استرس) است (24). این مفهوم بر اساس فعالیت الکتریکی مغز در باندهای فرکانسی مختلف (مانند دلتا برای حالات کند، آلفا برای آرامش، و بتا/گاما برای برانگیختگی بالا) محاسبه میشود و با سیستمهایی مانند Ascending Reticular Activating System (ARAS) مرتبط است که شامل ساختارهایی مانند reticular formation ساقه مغز، هستههای intralaminar تالاموس، و قشر مغز میشود. سطح arousal نه تنها به هوشیاری کمک میکند، بلکه با پاسخهای فیزیولوژیک مانند ضربان قلب، رسانایی پوست، و ترشح کورتیزول همبستگی دارد و اختلال در آن میتواند منجر به علائمی مانند بیخوابی، خستگی، یا بیش فعالی شود (25).
در نرمافزارهای سنتی مانند NeuroGuide، شاخص arousal level به صورت مستقیم و بصری ارائه نمیشود و پزشکان باید آن را از دادههای خام استنباط کنند، که این امر میتواند ناکار آمد و پرخطا باشد. در مقابل، گزارشهای QEEGhome با ادغام همزمان مارکرهای خطی و غیر خطی، این شاخص را به صورت یک جدول استخراج و نمایش میدهد (26).

در بیماران مبتلا بهOCD ، سطح برانگیختگی اغلب ناهمگون و متفاوت از اختلالات اضطرابی دیگر است. برخلاف PTSD یا GAD که با برانگیختگی خودکار بالا (hyperarousal) همراه معمولاً با arousal uniform بالا همراه نیست (25). مطالعات نشان میدهند که بیماران OCD پروفایل arousal متفاوتی دارند، مانند افزایش فعالیت بتا در نواحی frontal (مرتبط با اضطراب مزمن و کنترل تکانه) اما بدون افزایش یکنواخت در شاخصهای فیزیولوژیک مانند ضربان قلب یا رسانایی پوست (25). این تفاوت میتواند به تمایز OCD از اختلالات مشابه کمک کند و نشان دهنده این باشد که OCDبیشتر با اختلال در شبکههای کنترل شناختی (مانند مدارهای frontostriatal) همراه است تا arousalکلی بالا. در برخی موارد، OCD ممکن است با arousal پایینتر در نواحی posterior همراه باشد، که با علائم وسواسی مانند نشخوار فکری و کاهش آرام سازی مغزی همخوانی دارد (23).
در صورت تمایل به مطالعه مقاله Arousal Level، روی لینک کلیک کنید.
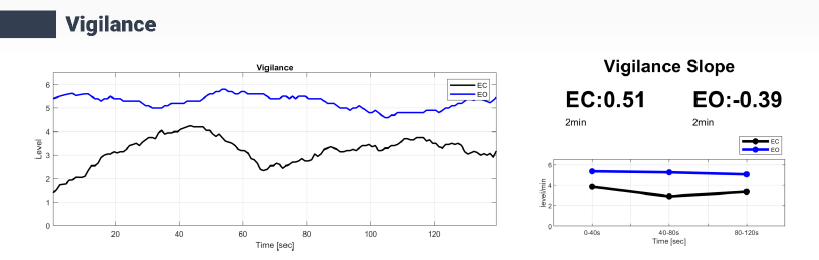
بررسی هوشیاری (Vigilance) در اختلال وسواس اجباری (OCD) یکی از جنبههای کلیدی برای درک بهتر پاتوفیزیولوژی و مدیریت این اختلال است. هوشیاری به عنوان ظرفیت حفظ بیداری و توجه پایدار تعریف میشود و ارتباط نزدیکی با سطح برانگیختگی مغزی و عملکرد شناختی دارد. در بیماران مبتلا به OCD، الگوهای هوشیاری اغلب ناهمگون بوده و با تغییرات در مراحل هوشیاری بالا و انتقالهای غیرمنتظره بین حالات مشخص میشود (26).
تحقیقات نشان میدهند که بیماران OCD معمولاً پروفایلی از vigilance ناپایدار دارند، که شامل نوسانات در زمان سپریشده در مراحل A1 (هوشیاری بالا) و افزایش فعالیت بتا در نواحی frontal مرتبط با اضطراب مزمن است. این الگو با علائم وسواسی مانند نشخوار فکری و مشکلات توجه پایدار مرتبط است و میتواند با آزمونهایی مانند Continuous Performance Test (CPT) تأیید شود. در مقابل، این ناهمگونی ممکن است به عنوان مکانیسم جبرانی برای مدیریت اضطراب و کنترل impuls توضیح داده شود. دادههای QEEG نیز این ناپایداری را تأیید میکند و میتواند به تمایز OCD از اختلالات مشابه مانند اضطراب عمومی (GAD) که با vigilance یکنواخت مشخص میشود، کمک کند(27).
از نظر بالینی، بررسی vigilance با استفاده از ابزارهایی مانند QEEG میتواند به پیشبینی پاسخ به درمانهای دارویی، مانند مهارکنندههای بازجذب سروتونین (SSRIs)، و مداخلاتی مانند نوروفیدبک منجر شود (28).
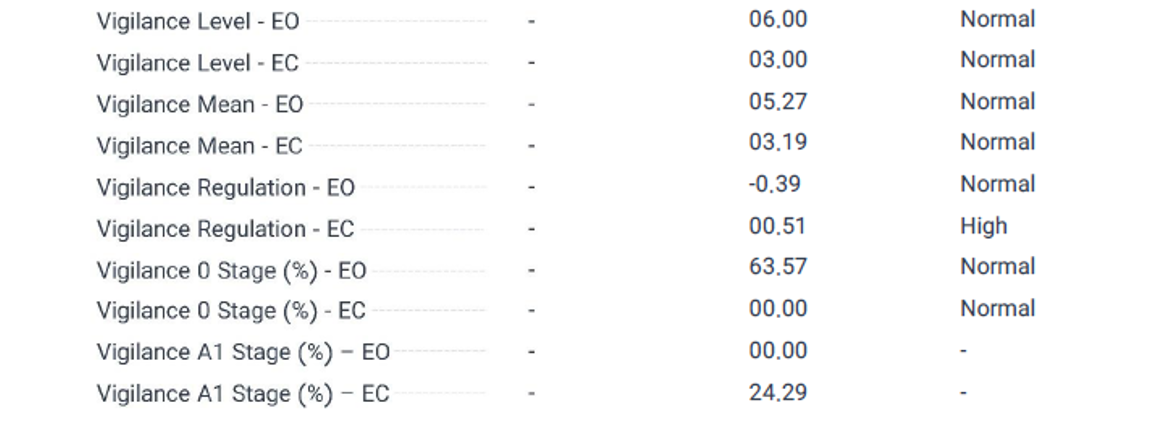
بر اساس دادههای جدول EEG Neuromarker Values ، شاخصهای هوشیاری در این بیمار مبتلا به OCD نشاندهنده الگوی ناهمگونی در سطح برانگیختگی است. به عنوان مثال، Vigilance Level-EO با مقدار 06.00 و Vigilance Mean-EO با مقدار 05.27 در محدوده "Normal" قرار دارند، اما کاهش APF در نواحی frontal در حالتEO ، پایینتر از نرمال و occipital در حالت EO میتواند به ناپایداری توجه و افزایش اضطراب مزمن مرتبط باشد، که با OCD سازگار است. این کاهش ممکن است به اختلال در تنظیم برانگیختگی قشری (cortical arousal) اشاره داشته باشد، که با افزایش فعالیت بتا در نواحی frontal با ارزش -0.18) نیز همخوانی دارد و نشاندهنده تلاش برای کنترل impuls است). همچنین، Vigilance Regulation-EC با مقدار 00.51 (بالا) نشاندهنده ناپایداری در تنظیم هوشیاری است، که با علائم وسواسی مانند نشخوار فکری و کاهش آرامسازی مغزی در نواحی posterior مرتبط است.
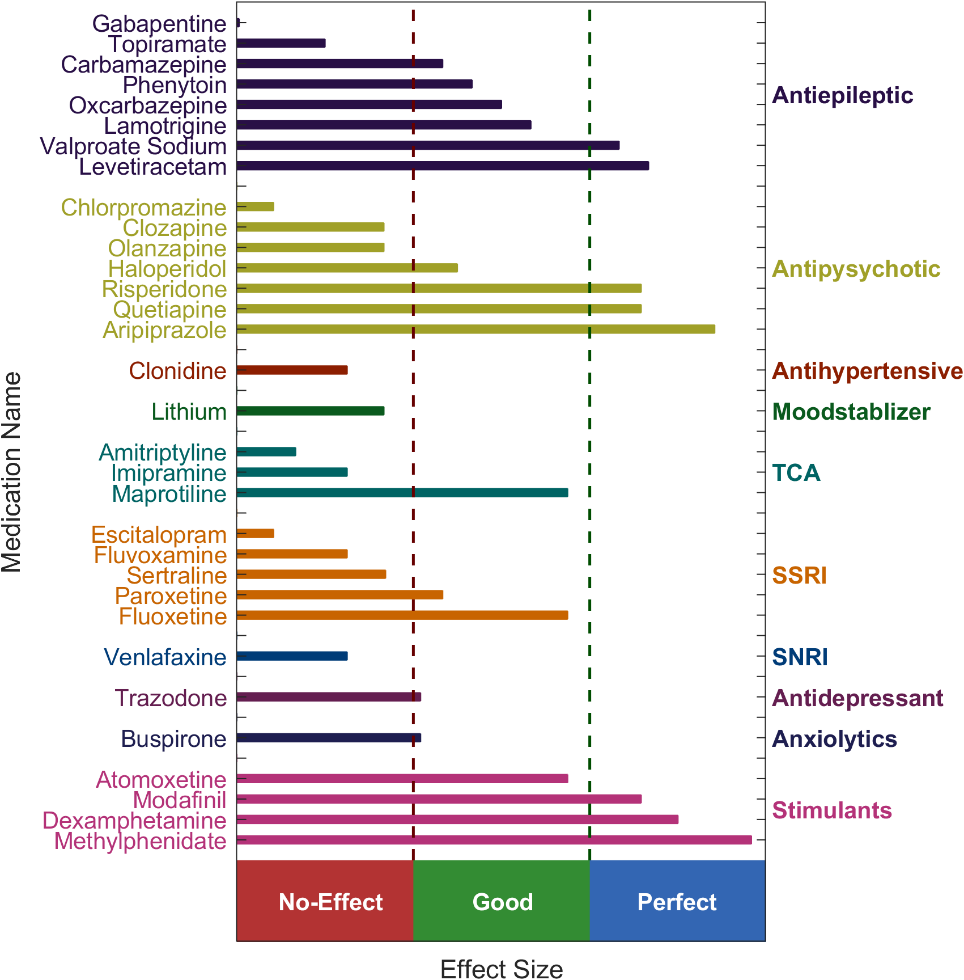
در ادامه بررسی نقش QEEG در تشخیص و درمان OCD، به صفحه پیش بینی پاسخ دارویی (Medication Response Page)در گزارشهای QEEGhome میرسیم. این صفحه ابزاری پیشرفته و شخصی سازی شده است که با استفاده از ویژگیهای زیستی منحصر به فرد مغز هر فرد، مانند توان امواج مغزی، عدم تقارن، همگام سازی و شاخصهای غیر خطی در دادههای QEEG، پیش بینی میکند که کدام دارو برای بیمار بهترین اثر را خواهد داشت. این ابزار با تحلیل الگوهای مغزی بیمار نشان میدهد کدام داروها احتمالاً پاسخ درمانی بهتری ایجاد میکنند و کدامها ممکن است بی تأثیر باشند یا مقاومت به آنها وجود داشته باشد، که این امر بر پایه شواهد pharmaco-QEEG استوار است. پزشک پس از ارزیابی بالینی، تعیین تشخیص اولیه و انتخاب کلاس یا چند گزینهٔ دارویی مدنظر، به این نقشه دارویی مراجعه میکند تا احتمال اثر بخشی هر دارو را بر اساس شواهد pharmaco-EEG مقایسه کند. سپس با در نظر گرفتن تداخلات دارویی، عوارض جانبی، بیماریهای همراه، ترجیحات بیمار و الزامات ایمنی، از میان گزینهها موثرترین و مناسبترین دارو را برای همان بیمار برمیگزیند. آستانههای «No-effect / Good / Perfect» صرفاً شاخصهای کمکی مبتنی بر شواهد برای رتبه بندیاند و جایگزین قضاوت بالینی یا راهنماهای درمانی نیستند؛ تصمیم نهایی ترکیبی از شواهد QEEGو ملاحظات بالینی است.
در نمودار ارائهشده توسط QEEGhome، داروها بر اساس دسته بندیهای مختلف (مانند Antiepileptic، Antipsychotic، Mood stabilizer، TCA، SSRI، SNRI، Antidepressant، Anxiolytics و Stimulants) با مقیاس افقی از "No-effect" (سمت چپ، نشاندهنده عدم پاسخ یا مقاومت) به "Good" (وسط، پاسخ متوسط) و "Perfect" (سمت راست، پاسخ عالی) نمایش داده شدهاند.
برای مثال، در دسته SSRIها که اغلب خط اول درمان OCD هستند، داروهایی مانند Fluvoxamine و Sertraline در محدوده "No-effect" تا "Good" قرار دارند، که این میتواند نشان دهنده پاسخ متوسط بر اساس الگوهای QEEG بیمار باشد، در حالی که Paroxetine و Escitalopram کمی بهتر (نزدیک به"Good") ارزیابی شدهاند. در دسته Antipsychoticها، داروهایی مانند Risperidone و Quetiapine در محدوده "Good" قرار گرفتهاند، که این میتواند برای موارد OCD مقاوم به درمان که نیاز به augmentation با آنتیسایکوتیکها دارند، مفید باشد. داروهای تحریککننده مانند Methylphenidate و Dextroamphetamine در محدوده "Good" تا "Perfect" ارزیابی شدهاند، که ممکن است برای OCD با هم آیندی ADHD مناسب باشد، اما نیاز به احتیاط دارد. این تفسیر، با ادغام دادههای QEEG بیمار، به روانپزشک کمک میکند تا از داروهایی مانند Clomipramine (در TCA ها، نزدیک به "Good") که مطالعات pharmaco-QEEG آن را به عنوان گزینه مؤثر در OCD مقاوم نشان میدهند، بهره ببرد و از گزینههای کم اثر مانند برخی آنتیاپیلپتیکها (مانند Carbamazepine در "No-effect") اجتناب کند. این صفحه، در نهایت، مسیر درمان را کوتاهتر و شخصی سازی شدهتر میکند و از آزمون و خطاهای غیر ضروری جلوگیری مینماید.
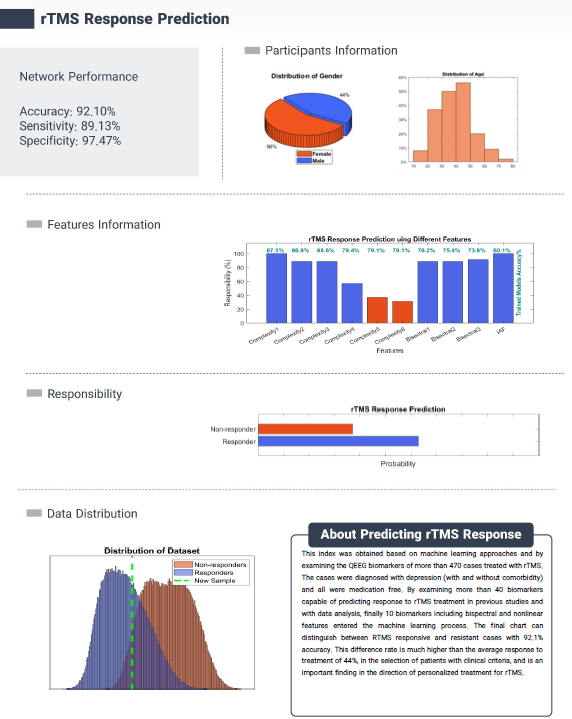
در ادامه بررسی ابزارهای پیشرفته در گزارشهای QEEGhome برای مدیریتOCD ، به صفحه پیش بینی پاسخ به rTMS (Repetitive Transcranial Magnetic Stimulation) میرسیم. ابتدا لازم است توضیح دهیم که rTMS چیست. rTMS یک روش درمانی غیر تهاجمی است که از میدانهای مغناطیسی پالسی برای تحریک مستقیم نواحی خاص مغز استفاده میکند. در این روش، یک کویل مغناطیسی روی پوست سر قرار میگیرد و پالسهای مغناطیسی کوتاه مدت تولید میشود که جریان الکتریکی خفیف بدون نیاز به جراحی یا بیهوشی در نورونهای قشر مغز ایجاد میکند،. این تحریک میتواند فعالیت عصبی را تعدیل کند، مانند افزایش یا کاهش اتصال پذیری در مدارهای مغزی، و اغلب برای درمان اختلالات روانپزشکی مانند افسردگی مقاوم، اضطراب و OCD به کار میرود. نحوه عملکرد آن بر پایه اصل تحریک تکراری است که میتواند پلاستیسیته عصبی را تغییر دهد، به عنوان مثال با هدف قرار دادن نواحی مانند medial prefrontal cortex (mPFC) یا anterior cingulate cortex (ACC) در OCD، که با کنترل وسواسها و اجبارها مرتبط هستند (30).
rTMS به عنوان یک درمان شناخته شده برای OCD، در سال ۲۰۱۸ توسط FDA (اداره غذا و دارو ایالات متحده) برای درمان این اختلال تأیید شد، به ویژه پروتکلهای Deep TMS که امکان تحریک عمیقتر نواحی مغزی را فراهم میکنند. این تأیید بر اساس مطالعات بالینی است که نشان دهنده کاهش قابل توجه علائم OCD در بیماران مقاوم به درمانهای استاندارد (مانند SSRIها یاCBT) هستند، با نرخ پاسخ حدود ۳۰-۵۰ درصد در برخی تحقیقات است (31،32).
صفحه پیش بینی پاسخ rTMS در گزارشهای QEEGhome با استفاده از نورومارکرها به بررسی احتمال پاسخ بیمار به این درمان میپردازد. این صفحه، که بر پایه الگوریتمهای یادگیری ماشین آموزش دیده بر دادههای QEEG توسعه یافته، دقت بالایی ارائه میدهد (33).
پزشک با استفاده از این صفحه، در کنار علائم بالینی بیمار (مانند شدت وسواسها، هم آیندیها مانند اضطراب یا افسردگی) و شرایط کلی (مانند سن، تاریخچه پزشکی و دسترسی به تجهیزات)، میتواند در رابطه با ادامه درمان با rTMS تصمیم گیری کند. برای مثال، اگر پیش بینی نشان دهنده پاسخ دهی بالا باشد (مانند Responder در نمودار)، پزشک میتواند rTMS را به عنوان گزینه اصلی پیشنهاد دهد، در حالی که در موارد non-responder، به سمت درمانهای جایگزین مانند داروهای augmentation یا نوروفیدبک حرکت کند. این رویکرد شخصی سازی شده، بر اساس شواهدQEEG ، نرخ موفقیت درمان را افزایش میدهد و از هزینههای غیر ضروری جلوگیری میکند (33).
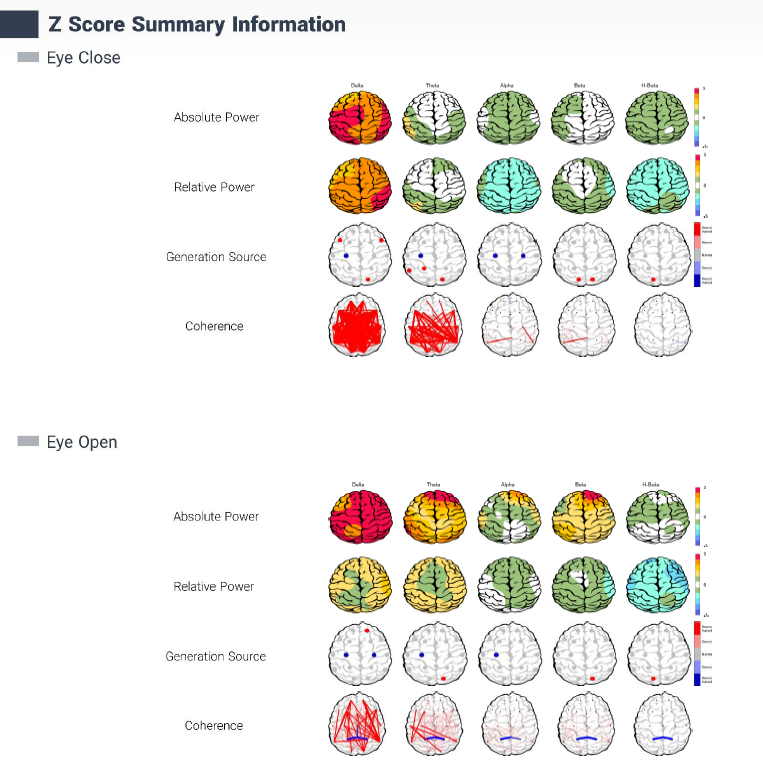
بخش Z-Score Information در گزارشها، نمایانگر انحراف استاندارد فعالیت امواج مغزی در باندهای فرکانسی (دلتا، تتا، آلفا، بتا و هایبتا) نسبت به یک پایگاه داده نرمال (پایگاه داده QEEGhome که تماما از افراد ایرانی سراسر کشور جمع آوری شده است) است و در دو حالت چشمان بسته (EC) و چشمان باز (EO) ارزیابی میشود. نقشههای توپوگرافیک با رنگهای مختلف (آبی برای انحرافات پایینتر، قرمز برای انحرافات بالاتر از نرمال) شدت این انحرافات را در نواحی مختلف مغز نشان میدهند. بخش Absolute Power قدرت مطلق امواج را و Relative Power درصد هر باند فرکانسی نسبت به کل فعالیت مغزی را نمایش میدهد. نقاط مشخصشده (مانند قرمز و آبی) نشاندهنده منابع تولید (Generation Source) هستند که انحرافات قابلتوجه را برجسته میکنند. این مارکر به شناسایی الگوهای غیرطبیعی، مانند افزایش دلتا در OCD، کمک میکند و برای تشخیص افتراقی و برنامهریزی درمانی مفید است.
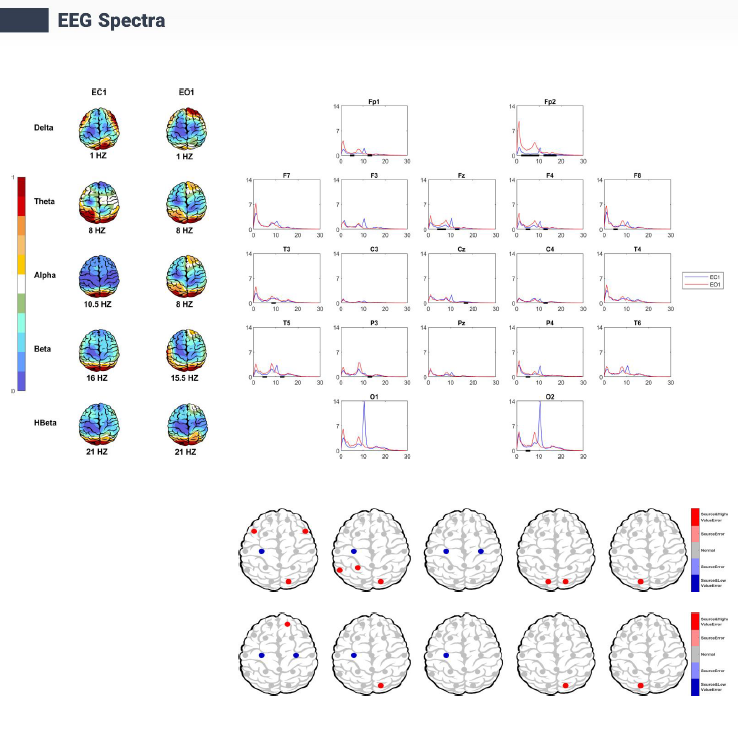
صفحه EEG Spectra در گزارشها، طیف توان QEEG با محاسبه چگالی طیفی توان در باندهای فرکانسی دلتا (0.5-4 هرتز)، تتا (4-8 هرتز)، آلفا (8-13 هرتز)، بتا (13-30 هرتز) و بتا بالا (20-30 هرتز) از طریق تبدیل سریع فوریه (FFT) روی دورههای 2-4 ثانیهای EEG، توزیع قدرت سیگنالهای مغزی را نشان میدهد. در این گزارش، نقشههای توپوگرافیک اوج توان هر باند را نمایش میدهند (مثل توان دلتا در 1 هرتز با تأکید فرونتال و آلفا در 10.5 هرتز با غالبیت پسسری)، در حالی که نمودارهای خطی الکترودها (مثل FP1، F7) تغییرات توان را بر حسب فرکانس (0-30 هرتز) به صورت لگاریتمی نشان میدهند. تغییرات این الگو ها با بیماری های مختلف روانپزشکی نسبت مستقیم دارند و همچنین این الگوها توان، انحرافات احتمالی از هنجارهای سنی را برجسته کرده و برای تحلیل اختلالات مغزی و کمک به تشخیص و همچنین برنامهریزی درمانی کاربرد دارند.
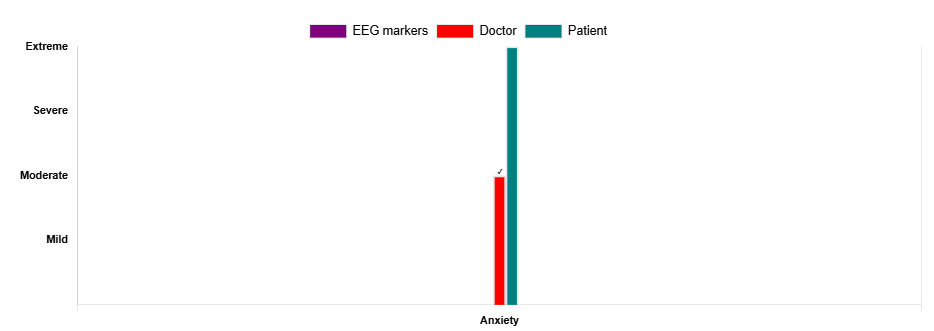
در ادامه بررسی ابزارهای پیشرفته در مدیریت OCD، به نقش پرسشنامهها به عنوان روشهای ارزیابی subjective میپردازیم. پرسشنامهها به عنوان ابزاری متداول در روانپزشکی، نقش غیر قابل انکاری در ارزیابی علائم بیمار دارند و به درک تجربه ذهنی او از علائم، مانند شدت وسواسها، اجبارها، یا اضطراب، کمک میکنند. ابزارهایی مانند مقیاس Y-BOCS یا مقیاس اضطراب BAI از جمله این روشها هستند که به صورت مستقیم از بیمار یا درمانگر اطلاعات جمع آوری میکنند (34).
در تیم QEEGhome، با درک اهمیت این روشهای ذهنی، بخشی اختصاصی برای درمانگران طراحی شده است که در کنار بارگذاری فایل خام نوار مغزی، امکان تکمیل پرسشنامهها را نیز فراهم میکند. این سیستم به گونهای عمل میکند که دیدگاه بیمار از علائم خود (بر اساس پاسخهای مستقیم) و دیدگاه بالینگر (بر اساس مشاهده و ارزیابی بالینی) را تحلیل میکند. در نهایت، این دادهها با اطلاعات استخراج شده از نقشه مغزی بیمار (مانند مارکرهای خطی و غیر خطی QEEG، APF و سطح arousal) ترکیب میشوند تا یک پرسپکتیو جامع و چند وجهی به درمانگر ارائه دهند (35). این رویکرد ترکیبی، به روانپزشک کمک میکند تا با در نظر گرفتن هم تجربه ذهنی بیمار و هم دادههای عینی مغزی، تشخیص دقیقتری ارائه کرده و برنامه درمانی شخصی سازی شدهتری (مانند ترکیب rTMS، داروها، یا نوروفیدبک) طراحی کند (36).
برای کسب اطلاعات بیشتر در رابطه با پرسش نامه ها و نحوه کار با آنها بر روی لینک کلیک کنید.
جهت کسب اطلاعات بیشتر و دریافت نمونه گزارش نقشه مغزی و ارتباط با پشتیبانی بر روی لینک کلیک کنید.